中医封神时刻!五味子活性成分登上《Nature》子刊,精准燃烧白色脂肪,一夜减重26.8%+胰岛素敏感性飙升,奥利司他黯然失色!
肥胖已从单纯的“富贵病”演变为全球公共卫生危机。最新《柳叶刀》报告显示,全球成年超重人口已突破25亿,其中肥胖者近9亿,中国以1.8亿肥胖人群位居榜首。更为严峻的是,现有干预手段——生活方式重塑、GLP-1受体激动剂、减重手术——均面临“反弹、副作用、可及性”三大瓶颈:单纯节食一年复重率>50%,GLP-1类药物胃肠不良反应占3成,袖状胃切除5年吻合口狭窄率约8%。因此,寻找“安全、可口服、靶点清晰”的新策略成为代谢病学与中医药领域的共同命题。
传统中药五味子自古用于“益气生津、收汗固表”,其木脂素成分Schisantherin A(Sin A)在肝保护、神经退行性h疾病模型中已显多效,但其在能量代谢中的角色长期未被揭示。
上海中医药大学丁丽丽/杨莉/黄文东联合团队发表于《自然-通讯》的最新研究,首次阐明Sin A通过“重塑肠道菌群—升高结合型胆汁酸(CBA)—激活脂肪组织TGR5-p-CREB-STAT6—驱动M2巨噬细胞-交感神经偶联产热”的完整轴心,为肥胖治疗提供了可口服、机制清晰、靶点可验证的天然小分子方案,也为“中医脾主运化”理论在现代代谢病学中的诠释提供了分子注脚。
图1 论文首图
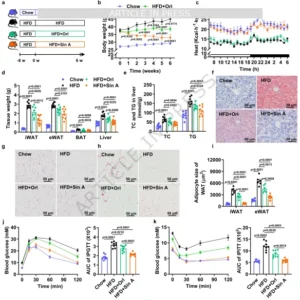
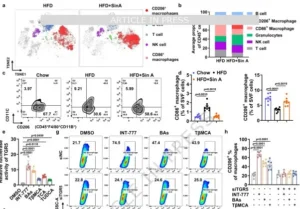
Sin A治疗导致DIO小鼠体重减轻并增强胰岛素敏感性
研究者首先建立60%高脂饲料(HFD)8周诱导的肥胖(DIO)雄性C57BL/6模型,以临床一线减肥药奥利司他为阳性对照,给予Sin A 20、40、80 mg·kg⁻¹·d⁻¹灌胃6周。结果令人振奋:Sin A 80 mg组体重下降26.8%,远超奥利司他的14.3%,且摄食量无差异;代谢笼显示24 h能量支出提高18%,呼吸交换率(RER)向脂肪氧化倾斜;以体重匹配实验校正后,仍见显著增耗,提示“吃得一样多,烧得更多”。组织学层面,Sin A治疗使腹股沟白色脂肪(iWAT)与附睾白色脂肪(eWAT)质量分别降低42%与35%,棕色脂肪(BAT)重量亦下降但UCP1蛋白表达升高,呈现“瘦身并激活”特征;肝脏TG、TC下降约30%,血清LDL-C降低、HDL-C升高;糖耐量试验AUC缩小32%,胰岛素耐量指数提高42%,提示全身胰岛素敏感性显著改善。值得注意的是,Sin A对正常饲料小鼠的体重、代谢指标、肝肾功能标志物(ALT、AST、CREA、BUN)及主要脏器组织学均无影响,显示其“只纠偏、不扰稳”的安全窗口。雌性DIO小鼠3周干预亦重现上述获益,排除了性别差异。至此,Sin A被确立为“有效且安全”的口服抗肥胖候选分子。
图2 Sin A治疗导致DIO小鼠体重减轻并增强胰岛素敏感性
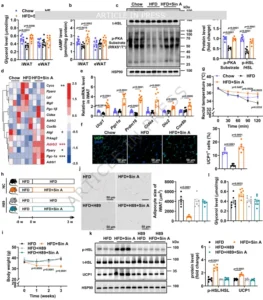
PKA信号通路对Sin A诱导的DIO小鼠脂肪分解是必需的
脂肪减少必然涉及脂解。团队发现Sin A仅使iWAT(而非eWAT)甘油释放增加2.1倍,cAMP水平升高1.8倍;Western blot显示磷酸化PKA底物(p-PKA substrate)与磷酸化激素敏感脂酶(p-HSL)均显著上调。为验证因果关系,研究者联合给予PKA抑制剂H89(10 mg·kg⁻¹·d⁻¹腹腔注射)。结果H89完全阻断Sin A的体重下降、能量支出增加、肝脂与脂肪库减少,并抑制iWAT中UCP1、p-HSL的诱导,提示PKA是Sin A启动脂解与产热的“守门激酶”。RNA-seq进一步揭示iWAT中Adrb3(β3-肾上腺素受体)与经典棕色基因(Ucp1、Pgc1α、Cox8b、Dio2)同步上调,而H89可逆转这一转录特征,说明PKA信号不仅促进脂肪分解,更是白色脂肪“棕色化”程序的上游开关。
图3PKA信号通路对Sin A诱导的DIO小鼠脂肪分解是必需的
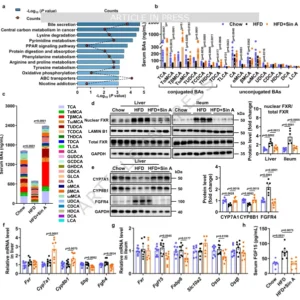
Sin A通过抑制DIO小鼠肝脏和回肠中FXR活性增强胆汁酸生物合成 胆汁酸(BA)因其“乳化脂肪”的经典形象被熟知,近年更被赋予“内分泌激素”新身份。团队利用非靶向血清代谢组发现,Sin A处理后BA分泌通路富集度最高;靶向定量显示,结合型胆汁酸(CBA)——牛磺-β-鼠胆酸(TβMCA)、牛磺胆酸(TCA)、牛磺熊脱氧胆酸(TUDCA)——浓度升高2–4倍,而粪便总BA下降,提示“肠肝循环重分布”。机制层面,Sin A显著抑制肝脏与回肠核内FXR(法尼醇X受体)蛋白水平,解除其对CYP7A1、CYP8B1的转录抑制,使BA合成限速酶表达上调;回肠FXR下游靶基因Fgf15、Osta、I-babp同步下调,血清FGF15降低,肝FGFR4表达减少,进一步解除对CYP7A1的负反馈。由此,Sin A通过“肝-肠双重抑制FXR”撬动BA合成开关,导致具有代谢活性的CBA池扩增。
图4 Sin A通过抑制DIO小鼠肝脏和回肠中FXR活性增强胆汁酸生物合成
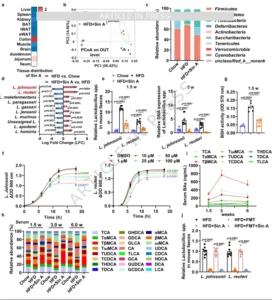
Sin A降低表达BSH的肠道细菌丰度
CBA的“去结合”由肠道菌群胆汁盐水解酶(BSH)催化。16S rRNA与宏基因组测序联合显示,Sin A不改变整体α多样性,却显著降低厚壁菌门中Lactobacillus属丰度;在种水平,高脂诱导的L. johnsonii、L. reuteri、L. murinus、L. jensenii、L. gasseri被Sin A选择性抑制,其中L. johnsonii与L. reuteri log-fold变化最大。体外培养证实,Sin A在1–100 μM范围内剂量依赖抑制上述两株菌,但对代谢有益的非BSH菌Akkermansia muciniphila无影响;粪悬液BSH酶活性下降60%,且与CBA升高呈负相关。为验证菌群必要性,团队采用“抗生素清除+粪菌移植”金标准:广谱抗生素(ABX)预处理后,Sin A的减重、改善糖耐、增加UCP1等效应完全消失;将Sin A处理小鼠的粪菌移植给ABX-空白受体,3周内即可“复制”减重、降脂、提高能量支出等表型,并伴随L. johnsonii/L. reuteri减少与BSH活性下降。由此,Sin A通过“抑菌—保CBA”发挥代谢益处,肠道菌群是必需环节。
图5 Sin A降低表达BSH的肠道细菌丰度
Sin A通过CBA激活TGR5信号通路,诱导DIO小鼠脂肪组织中M2型巨噬细胞极化
CBA如何“远程”作用于脂肪组织?团队聚焦已知BA受体TGR5。CyTOF质谱流式与常规流式一致显示,Sin A显著增加iWAT基质血管组分(SVF)中M2样巨噬细胞(CD45⁺F4/80⁺CD11b⁺CD206⁺)比例,而M1、B、T细胞相应减少;qRT-PCR验证M2标志基因Mrc1、Arg1、Clec10a、Stat6上调。体外实验,TβMCA、BA混合物或TGR5激动剂INT-777均可直接提高THP-1巨噬细胞CD206阳性率,而TGR5敲除(TGR5-KD)或Tgr5⁻/⁻原代SVF细胞则失去该效应,表明CBA-TGR5耦合是M2极化的直接驱动。Seahorse呼吸测试进一步显示,TβMCA使M2巨噬细胞基础氧耗与储备呼吸能力提高40%,提示其脂肪酸氧化(FAO)增强;CD36、Cpt1b、Pgcla等脂代谢基因同步上调,显示M2细胞“吃油能力”提升,为后续产热提供能量底物。
图6 Sin A通过CBA激活TGR5信号通路,诱导DIO小鼠脂肪组织中M2型巨噬细胞极化
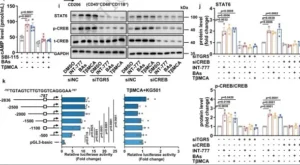
Sin A在巨噬细胞中激活TGR5–p-CREB–STAT6信号通路
TGR5作为Gs偶联受体,激活腺苷酸环化酶—cAMP—PKA轴,促使CREB磷酸化。Western blot显示,Sin A处理小鼠iWAT-SVF中p-CREB与STAT6蛋白显著上调;在THP-1细胞,INT-777、TβMCA均可提高p-CREB与STAT6,而TGR5-KD阻断这一效应;CREB-siRNA亦抑制STAT6蛋白,提示“TGR5→CREB→STAT6”级联。启动子区分析发现,STAT6上游-1100至-500 bp含典型cAMP反应元件(CRE),EMSA证实CREB可直接结合该位点;荧光素酶报告基因显示,TβMCA或CREB激动剂Forskolin可激活全长STAT6启动子,而CRE抑制剂KG-501取消激活。由此,CBA通过TGR5-cAMP-PKA使CREB磷酸化并直接结合STAT6启动子,完成“代谢信号—免疫转录”的分子嫁接。
图7 Sin A在巨噬细胞中激活TGR5–p-CREB–STAT6信号通路
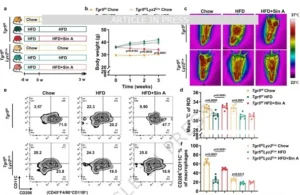
Sin A通过TGR5–STAT6信号通路促进M2型极化并带来代谢益处
为验证该轴心在体必要性,团队采用骨髓特异性Tgr5敲除(Tgr5ᶠᶠLyz2Cre)DIO模型。Sin A在Tgr5ᶠᶠ对照小鼠显著减重、降低血清TG/TC、减少肝脂与脂肪体积、提高能量支出与iWAT温度,并增加M2比例;而在Tgr5ᶠᶠLyz2Cre小鼠,上述获益全部消失,UCP1、脂解指标亦不升高。同理,STAT6整体敲除(Stat6⁻/⁻)小鼠亦完全抵抗Sin A的代谢改善与M2极化。流式与免疫荧光共同表明,Sin A无法增加Stat6⁻/⁻脂肪组织中的M2巨噬细胞,且UCP1、产热表型缺失。由此,Sin A依赖“TGR5-STAT6”骨髓细胞固有通路,完成M2极化与后续代谢收益,确立该轴心为天然产物干预肥胖的“非冗余”靶点。
图8 Sin A通过TGR5–STAT6信号通路促进M2型极化并带来代谢益处
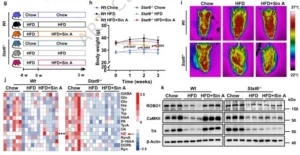
Sin A通过M2型巨噬细胞中SLIT3上调及交感神经元去甲肾上腺素增强脂肪组织产热作用
M2巨噬细胞如何“对话”脂肪细胞?团队聚焦SLIT3-ROBO1轴。既往报道脂肪驻留M2细胞分泌SLIT3,通过ROBO1激活交感神经元CaMKII-TH通路,促进去甲肾上腺素(NE)释放,进而激动脂肪细胞ADRB3-cAMP-PKA-UCP1级联。实验发现,Sin A显著升高iWAT中SLIT3蛋白与NE水平,并增加TH、ROBO1、CaMKII表达;Stat6敲除则阻断该系列变化,iWAT温度不再升高。为验证SLIT3与ROBO1的“非冗余”作用,团队利用AAV2/8-shRNA分别在iWAT局部敲低Slit3或Robo1。结果两种敲低均完全废除Sin A的减重、降脂、提高能量支出、升高局部温度及诱导UCP1/p-HSL的能力,而 scramble 病毒组效应完好。至此,Sin A通过“菌群-CBA-TGR5-STAT6”轴心驱动M2巨噬细胞分泌SLIT3,激活交感神经元ROBO1-CaMKII-TH,释放NE,完成“免疫-神经-脂肪”三方对话,最终触发白色脂肪棕色化与产热。
图9 Sin A通过M2型巨噬细胞中SLIT3上调及交感神经元去甲肾上腺素增强脂肪组织产热作用
结语
该研究以Sin A为探针,首次绘制“口服天然小分子-肠道菌群-胆汁酸-TGR5-巨噬细胞-交感神经-脂肪产热”的完整代谢调控蓝图,为肥胖治疗提供“调菌群、保CBA、促产热”三位一体的新策略。中医“脾主运化、肝主疏泄”理论在现代语境下可解读为“肝-肠-菌-免疫-神经”多脏器协同,Sin A正扮演“疏肝理脾、调菌助运”的现代分子使者。未来,围绕Sin A的临床药代、剂量优化、长期安全性及与现有减重手段的联合策略值得进一步探索;同时,靶向抑制L. johnsonii/L. reuteri或BSH酶的二代益生菌/噬菌体方案,亦可能成为“精准菌群干预”的新赛道。对于临床医生而言,这意味着在不远的将来,我们可能拥有一种源自传统中药、机制清晰、可口服、可监测、可联合的天然小分子,为全球10亿肥胖患者提供更安全、更个体化的代谢健康解决方案。
参考文献: Wang X, Wang X, Yu S, Huang L, Xue Q, Yang X, Wang Z, Lin W, Jiang Y, Xu Y, Liao Q, Jin L, Wang Z, Tao F, Yang L, Huang W, Ding L. Schisantherin A interacts with gut bacteria to stimulate adipose tissue thermogenesis in obese mice via a TGR5‒p-CREB‒STAT6 signaling pathway. Nat Commun. 2025 Dec 11. doi: 10.1038/s41467-025-67172-y. Epub ahead of print. PMID: 41381461.
作者|梅斯医学 编辑 | 逅思 授权转载、投稿等请联络梅斯医学管理员 老中医(微信号:wxid_rszr95aw79ie22)