癌症是一种常见且复杂的疾病,已成为全球第2大致死病因,严重威胁人类健康[1]。最新研究数据显示,2020年全球有1930万新增癌症病例和1000万癌症死亡病例,且我国癌症发病率和死亡率均位居全球第一[2]。手术治疗、化疗、放疗是目前临床治疗癌症的常规方法。由于癌症早期症状并不明显,大多数患者就诊时往往处于癌症中晚期,已不适合手术治疗;而放疗、化疗虽然是治疗癌症的标准方法,但因放疗、化疗对机体的不良反应严重,常常引起肿瘤耐药性等问题,其预后和疗效不尽人意[3]。因此,寻找安全、高效、低毒、增敏且能提高机体免疫力的抗肿瘤药物,阐明药物抗肿瘤分子机制是解决目前临床癌症治疗困难的有效策略[4]。
中药一直是抗肿瘤药物的重要来源,自古以来就被广泛用于单独或辅助治疗癌症,且现代临床应用的许多抗肿瘤药物亦均来自中药及其生物活性成分[5]。中药及其有效成分在防治癌症方面相较于其他药物具有更明显的优势及广阔的应用前景。一方面,中药常包含多种活性成分,能通过多靶点、多途径产生相互叠加或协同的抗癌药理活性[6];另一方面,中药有效成分多源于天然药物,不良反应小,更易于被机体吸收利用,目前已从中药中发现多种具有抗癌作用且能明显减轻化疗药物不良反应的有效成分[7]。因此,从中药中寻找更有效、更安全的化学成分对抗癌药物的开发具有建设性意义。
蒲公英为菊科植物蒲公英Taraxacum monogolicum Hand. -Mazz.、碱地蒲公英T. borealisinense Kitam.或同属数种植物的干燥全草,具有清热解毒、消肿散结、利尿通淋之功效,可用于治疗乳痈、瘰疬、疔疮肿毒等症[8]。传统中医临床研究发现,蒲公英在治疗乳腺癌、胃癌、肠癌等多种恶性肿瘤中疗效显著[9-11]。现代临床及药理学研究表明,蒲公英及其有效成分除具有抗炎、抗氧化等药理活性外,其抗肿瘤作用更为显著[12]。目前已有多项研究表明蒲公英有效成分对乳腺癌、肺癌、肝癌等多种癌症具有显著抑制作用,但其分子作用机制尚不清楚,极大地限制了其作为抗癌药物的研发及临床应用。因此,本文对蒲公英的化学成分组成和有效成分的提取以及有效成分抗肿瘤的作用机制进行综述,以期为临床新型高效低毒抗癌药物研发提供药理学依据及科学参考。
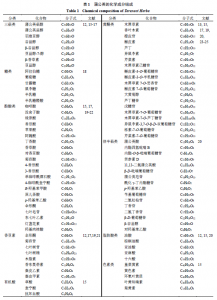
目前已从蒲公英中分离出多种化学成分,主要含有三萜类、糖类、黄酮类、酚酸类、倍半萜类、香豆素、脂肪酸类、有机酸类、色素类等,除此之外还富含维生素(A、B、C、D和E)、氨基酸、碳水化合物、胆碱、肌醇、卵磷脂、矿物质和微量元素(钙、钠、镁、铁、硅、铜、磷、锌、锰、钾)[12-14]。蒲公英中主要化学成分如表1所示。
 蒲公英全草提取物及蒲公英根提取物富含多种有效成分,主要包括蒲公英萜醇、蒲公英甾醇、蒲公英多糖、蒲公英黄酮等。现代研究揭示蒲公英具有抗肿瘤、抗炎、抗氧化、抗病毒等多种药理活性[13],但由于提取方法的不同,相同剂量提取的蒲公英各种有效成分的含量不同,药理作用也不尽相同。蒲公英有效成分传统提取方法为水提醇沉法,但该方法耗能高、得率低、操作时间长[26]。与水提醇沉法相比,超声波提取法可高效、快速击破细胞壁,显著提高蒲公英有效成分的萃取率[27]。相较于水提醇沉法,微波萃取法可使细胞膜和细胞壁中的酶失活,减少萃取剂的用量,缩短提取时间,提高有效成分的产量[28]。纤维素是蒲公英细胞壁的主要成分,用纤维素酶提取蒲公英有效成分,可以提高蒲公英有效成分的含量[20]。此外,超高压提取法也可用于蒲公英有效成分的提取[28]。
细胞凋亡是一种程序性的细胞死亡,诱导细胞凋亡是抗肿瘤的常见机制,也是筛选、研发抗肿瘤新药的重要措施之一[29]。研究证实,导致细胞凋亡的主要途径有2种:线粒体应激参与的内源性途径和死亡受体介导的外源性途径。线粒体途径主要由低氧、感染、细胞内钙离子浓度增加、氧化应激等凋亡刺激因子来激活,这些凋亡刺激因子激活了B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)蛋白家族中Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)和Bcl-2蛋白拮抗剂(Bcl-2 antagonist/killer,Bak)的表达,并结合到线粒体外膜形成Bax-Bak孔道,导致线粒体外膜通透性增加并介导细胞色素C(cytochrome c,Cyt-c)的释放,进入胞质的Cyt-c与凋亡蛋白酶激活因子-1(apoptotic protease activating factor-1,Apaf-1)和半胱氨酸天冬氨酸蛋白酶-9(cystein asparate protease-9,Caspase-9)结合形成凋亡体,并激活Caspase-3引发Caspase级联反应,诱导细胞凋亡。在死亡受体途径中,通过死亡信号与死亡因子受体配体(如Fas/FasL和肿瘤坏死因子)的结合来激活信号转导级联反应,一旦接收到细胞外的死亡信号,Caspase-8被激活,并引发下游Caspase的活化,诱导细胞凋亡[30]。大量研究证实,蒲公英有效成分既能通过线粒体途径诱导肿瘤细胞凋亡,也能通过死亡受体途径诱导肿瘤细胞凋亡。
2.1.1线粒体途径 蒲公英有效成分诱导细胞凋亡大多数是通过线粒体途径来实现的。与正常胚胎肺成纤维MRC-5细胞相比,蒲公英提取物能够引起抗凋亡蛋白Bcl-2和Bcl-xL表达下调,通过激活Caspase-9和Caspase-3的级联反应产生诱导人肺癌A549细胞凋亡的效应,其半数抑制浓度(median inhibition concentration,IC50)为97.7 µg/mL[31]。蒲公英提取物100 mg/mL还可通过破坏线粒体完整性来诱导儿童肿瘤SH-SY5Y、Kelly细胞凋亡,凋亡率分别为33.4%和34.0%[32]。在人乳腺癌MDA-MB-231、人胰腺癌PANC-1细胞中,蒲公英根提取物通过破坏线粒体膜电位,激活Caspase-9和Caspase-3以及下调Bcl-2的表达来诱导细胞凋亡,蒲公英根提取物15 g/L可使MDA-MB-231细胞的凋亡率达到85%[33-34]。蒲公英根提取物还能通过上调Bax蛋白表达,下调Bcl-2蛋白表达,激活腺苷酸活化蛋白激酶信号通路,来诱导人肝癌HepG2细胞发生凋亡[35]。此外,蒲公英根提取物亦可呈剂量相关性抑制Bcl-2表达和磷脂酰肌醇3激酶(phosphoinositide 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路的激活,诱导人舌癌Tca-8113细胞凋亡[36]。多项研究表明,蒲公英萜醇在诱导细胞凋亡中也发挥着重要作用。不同浓度(5、10、20 µmol/L)的蒲公英萜醇处理A549细胞后,与对照组相比,凋亡率分别为10%、20%和29%[37]。蒲公英萜醇还可呈剂量相关性的上调Bax蛋白表达,下调Bcl-2蛋白表达,从而导致Cyt-c的释放和Caspase-9的激活,诱导人宫颈癌HeLa细胞和人胃癌HGC-27、NCI-N87细胞凋亡,其作用机制可能与抑制PI3K/Akt信号通路有关[38-39]。蒲公英甾醇可通过线粒体途径诱导肿瘤细胞凋亡。在人舌癌CAL-27细胞中,蒲公英甾醇能以剂量相关性诱导CAL-27细胞凋亡,与此同时,引发凋亡诱导的一系列生化反应,包括线粒体膜电位的丧失、Cyt-c向胞质的释放、Caspase-3的激活和Bcl-2下调[40]。
2.1.2死亡受体途径 与正常结肠粘膜上皮NCM460细胞相比,蒲公英根提取物可增加人结直肠癌HT-29细胞死亡受体通路中Caspase-8蛋白表达而导致细胞凋亡,且口服蒲公英根提取物40 mg/(kg·d)不会对小鼠产生毒性[41]。蒲公英根提取物通过激活Caspase-8和Caspase-3的级联反应诱导人胰腺癌BXPC-3和PANC-1细胞凋亡[42]。此外,蒲公英根提取物40、80、120 µg/mL可通过抑制内质网应激相关信号来介导MDA-MB-231细胞凋亡,凋亡率分别为3.2%、12.8%、27.1%[43]。
肿瘤细胞迁移和侵袭是恶性肿瘤转移扩散的重要过程,称为侵袭–迁移级联反应,涉及多环节、多因素的参与[44]。近年来,国内外众多基础实验及临床研究证实,上皮间质转化(epithelial-mesenchymal transition,EMT)进程在肿瘤的迁移与侵袭过程中发挥重要作用。在EMT进程中,肿瘤细胞间的黏附性减弱,上皮细胞特性减弱,而间质细胞特性增强,具体表现为N–钙黏蛋白(N-cadherin)表达升高,E-cadherin表达降低[4,45]。桑利升等[46]发现,蒲公英黄酮类醇提取物0.5 µg/mL处理人食管鳞癌KYSE30和TE-1细胞,与对照组相比,迁移率分别降至19.33%和18.32%,侵袭率分别降至31.12%和14.54%,且下调了锌指转录因子-1、闭锁小带蛋白-1及N-cadherin的表达,上调了E-cadherin的表达。经历EMT的细胞会增加基质金属蛋白酶(matrix metalloproteinase,MMPs)表达,因此,抑制MMPs的表达也是抑制癌症侵袭和转移的关键。郭钦钰等[47-48]研究发现,蒲公英提取物2.5 mg/mL作用于人胃癌BGC823细胞后,MMP-2 mRNA表达水平降低,与对照组相比,细胞迁移率和侵袭率分别降为64.64%、68.80%。在人乳腺癌MCF-7细胞中,蒲公英黄酮降低MMP-2和MMP-9蛋白的表达水平,且与对照组相比,蒲公英黄酮500 µmol/L可使细胞划痕愈合率和穿膜细胞数分别下降23.67%、49.05%[49]。过表达胰腺癌缺失位点4(deleted in pancreatic carcinoma 4,DPC4)可通过促进肿瘤细胞中EMT进程和MMP-2表达使细胞间黏附降低,促进HT-29细胞的迁移和侵袭,与对照组相比,蒲公英提取物可逆转这种促进作用[50]。此外,蒲公英甾醇既可通过调控EMT相关基因,也可抑制MMP-2和MMP-9表达而抑制人甲状腺乳头状癌TPC-1和BCPAP细胞的迁移和侵袭[51]。蒲公英有效成分也可通过调控长链非编码RNA(long non-coding RNA,LncRNA)的表达而抑制肿瘤细胞迁移和侵袭。与正常胃上皮GES-1细胞相比,蒲公英根提取物3 mg/mL可通过靶向下调LncRNA结肠癌相关转录因子1的表达,抑制人胃癌SGC7901和BGC823细胞的迁移和侵袭能力[52]。蒲公英萜醇可通过抑制LncRNA α/β水解酶域11反义RNA1介导的EMT相关蛋白的表达,增加人膀胱癌EJ细胞间的黏附,与对照组相比,蒲公英萜醇100 µmol/L可使细胞侵袭及迁移率分别降低68.23%、51.05%[53]。肿瘤的迁移与侵袭离不开信号分子之间的相互作用,研究证实蒲公英有效成分通过调节相关通路,发挥抗肿瘤作用。蒲公英根提取物对人食管鳞状细胞癌KYSE 450和NEC细胞迁移与侵袭具有良好的抑制作用,IC50值分别为11.34、6.97 mg/mL,其作用机制是通过阻断PI3K/Akt和Ras/Raf/Erk信号通路实现的[54]。Deng等[55]发现,在人乳腺癌MDA-MB- 468、MDA-MB-231细胞中,蒲公英提取物通过抑制信号转导与转录激活因子3(signal transducer and activator of transcription 3,STAT3)信号通路上调细胞程序性死亡配体1的表达及M2型巨噬细胞向M1型转化的诱导,从而抑制肿瘤细胞迁移和侵袭。在人膀胱癌T24细胞中,蒲公英甾醇可通过抑制基质细胞衍生因子-1(stromalcellderivedfactor-1,SDF-1)/趋化因子受体4(chemokine receptor 4,CXCR4)和Akt/雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路,下调MMP-2和MMP-9的活化,而抑制T24细胞迁移与侵袭[56]。
细胞周期调控因子在细胞分裂增殖中发挥重要作用,其异常表达使肿瘤细胞过度分裂与增殖,导致肿瘤扩散与转移,故抑制细胞周期调控因子的异常表达是抑制肿瘤细胞增殖的关键,而抑制肿瘤细胞增殖和肿瘤生长是抗肿瘤策略之一,亦是筛选、研发抗肿瘤药物的主要目标[57]。研究表明,蒲公英有效成分可通过影响细胞周期调控因子的表达而阻滞肿瘤细胞周期进程、抑制肿瘤细胞增殖。蒲公英萜醇1 µmol/L可通过影响细胞周期调控因子的表达,即下调细胞周期蛋白D1、增殖细胞核抗原的表达、上调p21的表达阻滞细胞周期于G0/G1期,从而抑制HGC-27和NCI-N87细胞增殖[39];此外蒲公英萜醇还可通过诱导癌细胞发生氧化应激性损伤而抑制MCF-7细胞增殖[58]。最新研究结果表明,蒲公英甾醇在体内外生物学模型中均能通过影响细胞周期调控因子的表达而显著抑制肝癌、胃癌细胞的增殖。在肝癌中,蒲公英甾醇在体外通过上调组氨酸三联体核苷酸结合蛋白1(histidine triad nucleotide-binding protein 1,Hint1)的表达以及下调细胞周期蛋白D1的表达,使细胞周期阻滞于G0/G1期,从而抑制人肝癌SK-Hep1、HepG2细胞增殖,其IC50值分别为17.0、9.9 µmol/L;同时,蒲公英甾醇5.0、7.5 mg/kg在体内呈剂量相关性地降低Ki-67的表达抑制肝癌荷瘤小鼠的肿瘤生长[59-60]。在胃癌体内异种移植瘤实验中,蒲公英甾醇25 μg/mL干预16 d可显著抑制瘤体生长[61]。此外,蒲公英多糖50、100、200、400 µg/mL可呈剂量相关性上调细胞周期调控因子抑癌基因p53的表达而抑制MCF-7细胞增殖活性[62]。
2.4.1调节糖代谢 与正常细胞不同,癌症的主要特征是代谢重编程,即使在氧气充足的条件下,癌细胞也会将葡萄糖转化为乳酸,这种被称为Warburg效应的有氧糖酵解有利于多种癌症的生长[63],因此,引发糖酵解功能障碍有利于抑制肿瘤的发生发展。蒲公英各有效成分恰好能够通过多种途径调节糖代谢水平,进而发挥抗肿瘤作用。用蒲公英萜醇处理人肺癌H1299和A549细胞后,有氧糖酵解中的关键酶己糖激酶的活性降低,糖酵解水平受到抑制[64]。蒲公英萜醇单体成分羽扇豆醇可通过抑制细胞能量代谢途径中乙酰辅酶A和三磷酸腺苷的生成,抑制MCF-7细胞糖代谢;蒲公英黄酮单体成分木犀草素通过阻滞有氧糖酵解中磷酸戊糖代谢酶活性抑制MCF-7细胞糖代谢[26]。在HGC-27细胞中研究蒲公英甾醇对糖代谢的影响,结果发现蒲公英甾醇降低了有氧糖酵解中3-磷酸甘油脱氢酶的水平[65]。
2.4.2调节铁代谢 癌细胞对铁的依赖性相较于正常细胞有所增加,巨噬细胞将铁传递给癌细胞,从而促进肿瘤生长[66]。蒲公英多糖200 mg/L可通过调节铁代谢而发挥抗肿瘤作用,一方面,蒲公英多糖在体外能通过降低铁代谢中包括铁调素、铁转运蛋白、铁负荷的表达发挥抗癌活性,显著抑制人肝癌Huh7、HepG2细胞的生长;另一方面,蒲公英多糖200 mg/kg可显著抑制小鼠肝癌Hepa1-6和H22细胞荷瘤小鼠肿瘤组织中的铁沉积[67]。
2.4.3抑制甘油磷脂代谢和嘌呤代谢 脂代谢异常是恶性肿瘤的重要特征,肿瘤细胞需要大量的脂质合成来满足各种细胞器的形成和其本身的特殊需求。在肿瘤细胞中,磷脂酰胆碱(phosphatidylcholines,PC)由Kennedy途径合成,即胆碱在胆碱激酶的作用下转化为磷酸胆碱,然后转化为胞二磷胆碱(cytidine diphosphate choline,CDPC),最后CDPC和二酰甘油缩合形成PC。而蒲公英提取物25 μg/mL时可以通过甘油磷脂代谢和嘌呤代谢途径抑制A549细胞中PC和嘌呤的合成发挥抗肿瘤作用[68]。
2.5.1诱导肿瘤细胞自噬 自噬是细胞自我降解和保护的过程,在维持细胞内环境稳定中发挥着重要作用。自噬在癌细胞中发挥双重作用,一方面,自噬可以为癌细胞提供营养以维持其生存;另一方面,过度激活自噬可导致癌细胞自噬性死亡,从而为肿瘤治疗提供新途径[69]。进一步研究发现蒲公英有效成分能通过诱导细胞过度自噬而发挥抗肿瘤作用。蒲公英萜醇干预MCF-7细胞后,mTOR/真核细胞翻译起始因子4E结合蛋白1(eukaryotic translation initiation factor 4E binding protein 1,4EBP1)途径受到抑制,同时,自噬相关蛋白酵母Atg6同系物(Beclin1)表达上调,微管相关蛋白1轻链3-I(microtubule-associated protein1 light chain 3-I,LC3-I)转变成LC3-II示蒲公英萜醇可靶向抑制mTOR/4EBP1途径而诱导细胞自噬[70-71]。蒲公英甾醇50 μg/mL可抑制促癌基因环指蛋白31(ring finger protein,RNF31)通过Pub结构域催化p53蛋白泛素化和降解而诱导人结肠癌HCT116和SW480细胞自噬[72]。
2.5.2抑制肿瘤血管生成 血管生成是肿瘤生长和转移的重要过程,为肿瘤细胞提供了充足的营养物质以加速肿瘤细胞的生长,这一过程涉及内皮细胞的增殖、侵袭、迁移和分化为毛细血管,因此,抑制血管生成是抑制肿瘤生长和转移的有效方法[73-74]。在肝癌体内外生物模型研究中发现,蒲公英多糖降低了肝癌缺氧诱导因子-1α和血管内皮生长因子(vascular endothelial growth factor,VEGF)蛋白表达,并抑制PI3K/Akt信号通路的激活,说明蒲公英多糖抗血管生成的作用机制与抑制血管生成诱导的信号通路有关[75]。
2.5.3联合化疗药物的增效减毒作用 化疗耐药是癌症治疗的一个障碍,而中药提供了解决这一障碍的新方法。多项研究表明,蒲公英有效成分在体内外均能增加化疗药物的治疗效果、减少化疗药物对机体的损伤。蒲公英根提取物4 mg/mL与化疗药物紫杉醇和米托蒽醌联合用药后对癌细胞具有协同促凋亡作用,不仅能够增强人前列腺癌DU-145细胞对紫杉醇和米托蒽醌的敏感性,且能够降低人前列腺癌异种移植瘤小鼠的肿瘤负荷,对小鼠的饮食和体质量无显著影响[76]。蒲公英总黄酮100、200 mg/kg能增加Lewis肺癌小鼠对化疗药环磷酰胺的敏感性,这种增敏作用是通过提高宿主的保护性免疫应答来实现的,且蒲公英总黄酮抑制小鼠肿瘤生长比环磷酰胺更加温和[77]。
蒲公英全草提取物及蒲公英根提取物富含多种有效成分,主要包括蒲公英萜醇、蒲公英甾醇、蒲公英多糖、蒲公英黄酮等。现代研究揭示蒲公英具有抗肿瘤、抗炎、抗氧化、抗病毒等多种药理活性[13],但由于提取方法的不同,相同剂量提取的蒲公英各种有效成分的含量不同,药理作用也不尽相同。蒲公英有效成分传统提取方法为水提醇沉法,但该方法耗能高、得率低、操作时间长[26]。与水提醇沉法相比,超声波提取法可高效、快速击破细胞壁,显著提高蒲公英有效成分的萃取率[27]。相较于水提醇沉法,微波萃取法可使细胞膜和细胞壁中的酶失活,减少萃取剂的用量,缩短提取时间,提高有效成分的产量[28]。纤维素是蒲公英细胞壁的主要成分,用纤维素酶提取蒲公英有效成分,可以提高蒲公英有效成分的含量[20]。此外,超高压提取法也可用于蒲公英有效成分的提取[28]。
细胞凋亡是一种程序性的细胞死亡,诱导细胞凋亡是抗肿瘤的常见机制,也是筛选、研发抗肿瘤新药的重要措施之一[29]。研究证实,导致细胞凋亡的主要途径有2种:线粒体应激参与的内源性途径和死亡受体介导的外源性途径。线粒体途径主要由低氧、感染、细胞内钙离子浓度增加、氧化应激等凋亡刺激因子来激活,这些凋亡刺激因子激活了B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)蛋白家族中Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)和Bcl-2蛋白拮抗剂(Bcl-2 antagonist/killer,Bak)的表达,并结合到线粒体外膜形成Bax-Bak孔道,导致线粒体外膜通透性增加并介导细胞色素C(cytochrome c,Cyt-c)的释放,进入胞质的Cyt-c与凋亡蛋白酶激活因子-1(apoptotic protease activating factor-1,Apaf-1)和半胱氨酸天冬氨酸蛋白酶-9(cystein asparate protease-9,Caspase-9)结合形成凋亡体,并激活Caspase-3引发Caspase级联反应,诱导细胞凋亡。在死亡受体途径中,通过死亡信号与死亡因子受体配体(如Fas/FasL和肿瘤坏死因子)的结合来激活信号转导级联反应,一旦接收到细胞外的死亡信号,Caspase-8被激活,并引发下游Caspase的活化,诱导细胞凋亡[30]。大量研究证实,蒲公英有效成分既能通过线粒体途径诱导肿瘤细胞凋亡,也能通过死亡受体途径诱导肿瘤细胞凋亡。
2.1.1线粒体途径 蒲公英有效成分诱导细胞凋亡大多数是通过线粒体途径来实现的。与正常胚胎肺成纤维MRC-5细胞相比,蒲公英提取物能够引起抗凋亡蛋白Bcl-2和Bcl-xL表达下调,通过激活Caspase-9和Caspase-3的级联反应产生诱导人肺癌A549细胞凋亡的效应,其半数抑制浓度(median inhibition concentration,IC50)为97.7 µg/mL[31]。蒲公英提取物100 mg/mL还可通过破坏线粒体完整性来诱导儿童肿瘤SH-SY5Y、Kelly细胞凋亡,凋亡率分别为33.4%和34.0%[32]。在人乳腺癌MDA-MB-231、人胰腺癌PANC-1细胞中,蒲公英根提取物通过破坏线粒体膜电位,激活Caspase-9和Caspase-3以及下调Bcl-2的表达来诱导细胞凋亡,蒲公英根提取物15 g/L可使MDA-MB-231细胞的凋亡率达到85%[33-34]。蒲公英根提取物还能通过上调Bax蛋白表达,下调Bcl-2蛋白表达,激活腺苷酸活化蛋白激酶信号通路,来诱导人肝癌HepG2细胞发生凋亡[35]。此外,蒲公英根提取物亦可呈剂量相关性抑制Bcl-2表达和磷脂酰肌醇3激酶(phosphoinositide 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路的激活,诱导人舌癌Tca-8113细胞凋亡[36]。多项研究表明,蒲公英萜醇在诱导细胞凋亡中也发挥着重要作用。不同浓度(5、10、20 µmol/L)的蒲公英萜醇处理A549细胞后,与对照组相比,凋亡率分别为10%、20%和29%[37]。蒲公英萜醇还可呈剂量相关性的上调Bax蛋白表达,下调Bcl-2蛋白表达,从而导致Cyt-c的释放和Caspase-9的激活,诱导人宫颈癌HeLa细胞和人胃癌HGC-27、NCI-N87细胞凋亡,其作用机制可能与抑制PI3K/Akt信号通路有关[38-39]。蒲公英甾醇可通过线粒体途径诱导肿瘤细胞凋亡。在人舌癌CAL-27细胞中,蒲公英甾醇能以剂量相关性诱导CAL-27细胞凋亡,与此同时,引发凋亡诱导的一系列生化反应,包括线粒体膜电位的丧失、Cyt-c向胞质的释放、Caspase-3的激活和Bcl-2下调[40]。
2.1.2死亡受体途径 与正常结肠粘膜上皮NCM460细胞相比,蒲公英根提取物可增加人结直肠癌HT-29细胞死亡受体通路中Caspase-8蛋白表达而导致细胞凋亡,且口服蒲公英根提取物40 mg/(kg·d)不会对小鼠产生毒性[41]。蒲公英根提取物通过激活Caspase-8和Caspase-3的级联反应诱导人胰腺癌BXPC-3和PANC-1细胞凋亡[42]。此外,蒲公英根提取物40、80、120 µg/mL可通过抑制内质网应激相关信号来介导MDA-MB-231细胞凋亡,凋亡率分别为3.2%、12.8%、27.1%[43]。
肿瘤细胞迁移和侵袭是恶性肿瘤转移扩散的重要过程,称为侵袭–迁移级联反应,涉及多环节、多因素的参与[44]。近年来,国内外众多基础实验及临床研究证实,上皮间质转化(epithelial-mesenchymal transition,EMT)进程在肿瘤的迁移与侵袭过程中发挥重要作用。在EMT进程中,肿瘤细胞间的黏附性减弱,上皮细胞特性减弱,而间质细胞特性增强,具体表现为N–钙黏蛋白(N-cadherin)表达升高,E-cadherin表达降低[4,45]。桑利升等[46]发现,蒲公英黄酮类醇提取物0.5 µg/mL处理人食管鳞癌KYSE30和TE-1细胞,与对照组相比,迁移率分别降至19.33%和18.32%,侵袭率分别降至31.12%和14.54%,且下调了锌指转录因子-1、闭锁小带蛋白-1及N-cadherin的表达,上调了E-cadherin的表达。经历EMT的细胞会增加基质金属蛋白酶(matrix metalloproteinase,MMPs)表达,因此,抑制MMPs的表达也是抑制癌症侵袭和转移的关键。郭钦钰等[47-48]研究发现,蒲公英提取物2.5 mg/mL作用于人胃癌BGC823细胞后,MMP-2 mRNA表达水平降低,与对照组相比,细胞迁移率和侵袭率分别降为64.64%、68.80%。在人乳腺癌MCF-7细胞中,蒲公英黄酮降低MMP-2和MMP-9蛋白的表达水平,且与对照组相比,蒲公英黄酮500 µmol/L可使细胞划痕愈合率和穿膜细胞数分别下降23.67%、49.05%[49]。过表达胰腺癌缺失位点4(deleted in pancreatic carcinoma 4,DPC4)可通过促进肿瘤细胞中EMT进程和MMP-2表达使细胞间黏附降低,促进HT-29细胞的迁移和侵袭,与对照组相比,蒲公英提取物可逆转这种促进作用[50]。此外,蒲公英甾醇既可通过调控EMT相关基因,也可抑制MMP-2和MMP-9表达而抑制人甲状腺乳头状癌TPC-1和BCPAP细胞的迁移和侵袭[51]。蒲公英有效成分也可通过调控长链非编码RNA(long non-coding RNA,LncRNA)的表达而抑制肿瘤细胞迁移和侵袭。与正常胃上皮GES-1细胞相比,蒲公英根提取物3 mg/mL可通过靶向下调LncRNA结肠癌相关转录因子1的表达,抑制人胃癌SGC7901和BGC823细胞的迁移和侵袭能力[52]。蒲公英萜醇可通过抑制LncRNA α/β水解酶域11反义RNA1介导的EMT相关蛋白的表达,增加人膀胱癌EJ细胞间的黏附,与对照组相比,蒲公英萜醇100 µmol/L可使细胞侵袭及迁移率分别降低68.23%、51.05%[53]。肿瘤的迁移与侵袭离不开信号分子之间的相互作用,研究证实蒲公英有效成分通过调节相关通路,发挥抗肿瘤作用。蒲公英根提取物对人食管鳞状细胞癌KYSE 450和NEC细胞迁移与侵袭具有良好的抑制作用,IC50值分别为11.34、6.97 mg/mL,其作用机制是通过阻断PI3K/Akt和Ras/Raf/Erk信号通路实现的[54]。Deng等[55]发现,在人乳腺癌MDA-MB- 468、MDA-MB-231细胞中,蒲公英提取物通过抑制信号转导与转录激活因子3(signal transducer and activator of transcription 3,STAT3)信号通路上调细胞程序性死亡配体1的表达及M2型巨噬细胞向M1型转化的诱导,从而抑制肿瘤细胞迁移和侵袭。在人膀胱癌T24细胞中,蒲公英甾醇可通过抑制基质细胞衍生因子-1(stromalcellderivedfactor-1,SDF-1)/趋化因子受体4(chemokine receptor 4,CXCR4)和Akt/雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路,下调MMP-2和MMP-9的活化,而抑制T24细胞迁移与侵袭[56]。
细胞周期调控因子在细胞分裂增殖中发挥重要作用,其异常表达使肿瘤细胞过度分裂与增殖,导致肿瘤扩散与转移,故抑制细胞周期调控因子的异常表达是抑制肿瘤细胞增殖的关键,而抑制肿瘤细胞增殖和肿瘤生长是抗肿瘤策略之一,亦是筛选、研发抗肿瘤药物的主要目标[57]。研究表明,蒲公英有效成分可通过影响细胞周期调控因子的表达而阻滞肿瘤细胞周期进程、抑制肿瘤细胞增殖。蒲公英萜醇1 µmol/L可通过影响细胞周期调控因子的表达,即下调细胞周期蛋白D1、增殖细胞核抗原的表达、上调p21的表达阻滞细胞周期于G0/G1期,从而抑制HGC-27和NCI-N87细胞增殖[39];此外蒲公英萜醇还可通过诱导癌细胞发生氧化应激性损伤而抑制MCF-7细胞增殖[58]。最新研究结果表明,蒲公英甾醇在体内外生物学模型中均能通过影响细胞周期调控因子的表达而显著抑制肝癌、胃癌细胞的增殖。在肝癌中,蒲公英甾醇在体外通过上调组氨酸三联体核苷酸结合蛋白1(histidine triad nucleotide-binding protein 1,Hint1)的表达以及下调细胞周期蛋白D1的表达,使细胞周期阻滞于G0/G1期,从而抑制人肝癌SK-Hep1、HepG2细胞增殖,其IC50值分别为17.0、9.9 µmol/L;同时,蒲公英甾醇5.0、7.5 mg/kg在体内呈剂量相关性地降低Ki-67的表达抑制肝癌荷瘤小鼠的肿瘤生长[59-60]。在胃癌体内异种移植瘤实验中,蒲公英甾醇25 μg/mL干预16 d可显著抑制瘤体生长[61]。此外,蒲公英多糖50、100、200、400 µg/mL可呈剂量相关性上调细胞周期调控因子抑癌基因p53的表达而抑制MCF-7细胞增殖活性[62]。
2.4.1调节糖代谢 与正常细胞不同,癌症的主要特征是代谢重编程,即使在氧气充足的条件下,癌细胞也会将葡萄糖转化为乳酸,这种被称为Warburg效应的有氧糖酵解有利于多种癌症的生长[63],因此,引发糖酵解功能障碍有利于抑制肿瘤的发生发展。蒲公英各有效成分恰好能够通过多种途径调节糖代谢水平,进而发挥抗肿瘤作用。用蒲公英萜醇处理人肺癌H1299和A549细胞后,有氧糖酵解中的关键酶己糖激酶的活性降低,糖酵解水平受到抑制[64]。蒲公英萜醇单体成分羽扇豆醇可通过抑制细胞能量代谢途径中乙酰辅酶A和三磷酸腺苷的生成,抑制MCF-7细胞糖代谢;蒲公英黄酮单体成分木犀草素通过阻滞有氧糖酵解中磷酸戊糖代谢酶活性抑制MCF-7细胞糖代谢[26]。在HGC-27细胞中研究蒲公英甾醇对糖代谢的影响,结果发现蒲公英甾醇降低了有氧糖酵解中3-磷酸甘油脱氢酶的水平[65]。
2.4.2调节铁代谢 癌细胞对铁的依赖性相较于正常细胞有所增加,巨噬细胞将铁传递给癌细胞,从而促进肿瘤生长[66]。蒲公英多糖200 mg/L可通过调节铁代谢而发挥抗肿瘤作用,一方面,蒲公英多糖在体外能通过降低铁代谢中包括铁调素、铁转运蛋白、铁负荷的表达发挥抗癌活性,显著抑制人肝癌Huh7、HepG2细胞的生长;另一方面,蒲公英多糖200 mg/kg可显著抑制小鼠肝癌Hepa1-6和H22细胞荷瘤小鼠肿瘤组织中的铁沉积[67]。
2.4.3抑制甘油磷脂代谢和嘌呤代谢 脂代谢异常是恶性肿瘤的重要特征,肿瘤细胞需要大量的脂质合成来满足各种细胞器的形成和其本身的特殊需求。在肿瘤细胞中,磷脂酰胆碱(phosphatidylcholines,PC)由Kennedy途径合成,即胆碱在胆碱激酶的作用下转化为磷酸胆碱,然后转化为胞二磷胆碱(cytidine diphosphate choline,CDPC),最后CDPC和二酰甘油缩合形成PC。而蒲公英提取物25 μg/mL时可以通过甘油磷脂代谢和嘌呤代谢途径抑制A549细胞中PC和嘌呤的合成发挥抗肿瘤作用[68]。
2.5.1诱导肿瘤细胞自噬 自噬是细胞自我降解和保护的过程,在维持细胞内环境稳定中发挥着重要作用。自噬在癌细胞中发挥双重作用,一方面,自噬可以为癌细胞提供营养以维持其生存;另一方面,过度激活自噬可导致癌细胞自噬性死亡,从而为肿瘤治疗提供新途径[69]。进一步研究发现蒲公英有效成分能通过诱导细胞过度自噬而发挥抗肿瘤作用。蒲公英萜醇干预MCF-7细胞后,mTOR/真核细胞翻译起始因子4E结合蛋白1(eukaryotic translation initiation factor 4E binding protein 1,4EBP1)途径受到抑制,同时,自噬相关蛋白酵母Atg6同系物(Beclin1)表达上调,微管相关蛋白1轻链3-I(microtubule-associated protein1 light chain 3-I,LC3-I)转变成LC3-II示蒲公英萜醇可靶向抑制mTOR/4EBP1途径而诱导细胞自噬[70-71]。蒲公英甾醇50 μg/mL可抑制促癌基因环指蛋白31(ring finger protein,RNF31)通过Pub结构域催化p53蛋白泛素化和降解而诱导人结肠癌HCT116和SW480细胞自噬[72]。
2.5.2抑制肿瘤血管生成 血管生成是肿瘤生长和转移的重要过程,为肿瘤细胞提供了充足的营养物质以加速肿瘤细胞的生长,这一过程涉及内皮细胞的增殖、侵袭、迁移和分化为毛细血管,因此,抑制血管生成是抑制肿瘤生长和转移的有效方法[73-74]。在肝癌体内外生物模型研究中发现,蒲公英多糖降低了肝癌缺氧诱导因子-1α和血管内皮生长因子(vascular endothelial growth factor,VEGF)蛋白表达,并抑制PI3K/Akt信号通路的激活,说明蒲公英多糖抗血管生成的作用机制与抑制血管生成诱导的信号通路有关[75]。
2.5.3联合化疗药物的增效减毒作用 化疗耐药是癌症治疗的一个障碍,而中药提供了解决这一障碍的新方法。多项研究表明,蒲公英有效成分在体内外均能增加化疗药物的治疗效果、减少化疗药物对机体的损伤。蒲公英根提取物4 mg/mL与化疗药物紫杉醇和米托蒽醌联合用药后对癌细胞具有协同促凋亡作用,不仅能够增强人前列腺癌DU-145细胞对紫杉醇和米托蒽醌的敏感性,且能够降低人前列腺癌异种移植瘤小鼠的肿瘤负荷,对小鼠的饮食和体质量无显著影响[76]。蒲公英总黄酮100、200 mg/kg能增加Lewis肺癌小鼠对化疗药环磷酰胺的敏感性,这种增敏作用是通过提高宿主的保护性免疫应答来实现的,且蒲公英总黄酮抑制小鼠肿瘤生长比环磷酰胺更加温和[77]。
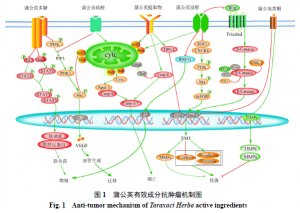 癌症的发病率和死亡率在逐年递增,严重威胁着人类健康与生命。恶性肿瘤常用治疗方法放疗和化疗虽然在一定程度上能抑制肿瘤生长,却无法避免治疗带来的不良反应和耐药性等问题。蒲公英抗肿瘤因其增效减毒作用而备受关注,蒲公英种子提取物能够增强化疗药顺铂对人食管鳞状细胞癌的敏感性[78];蒲公英水提物不仅能够增加肿瘤细胞对化疗药阿霉素的敏感性,而且还能降低阿霉素诱导的心脏毒性[79]。本文总结了蒲公英有效活性成分抗肿瘤的显著疗效,发现蒲公英根提取物及蒲公英中三萜类化合物蒲公英萜醇和蒲公英甾醇抗肿瘤作用研究最为广泛,且对正常细胞及小鼠没有毒性作用,在抗肿瘤药物研发及临床肿瘤治疗或辅助治疗中具有一定的优势和良好的应用前景。本文综述了蒲公英各有效活性成分抗肿瘤潜在分子机制,首先,通过抑制Janus激酶(Janus kinase,JAK)/STAT途径和促进p53表达抑制肿瘤细胞周期进程和细胞增殖;其次,通过线粒体途径和死亡受体途径诱导肿瘤细胞凋亡;此外,通过抑制EMT进程、MMP表达及阻止PI3K/Akt通路来抑制肿瘤细胞迁移和侵袭。蒲公英有效活性成分除了具有诱导细胞凋亡、抑制细胞迁移和侵袭、阻滞肿瘤细胞周期进程、抑制细胞增殖的作用外,还能在调节细胞代谢、诱导细胞自噬、抑制血管生成等方面发挥重要作用。
然而,现阶段蒲公英抗肿瘤研究主要集中在蒲公英根提取物和三萜类化合物,而对其他蒲公英有效活性成分抗肿瘤的作用机制研究较少,且关于蒲公英有效活性成分抗肿瘤的研究大多集中在基础药理机制方面,机制研究上形式较为单一,为了阐明具体抗肿瘤机制,有研究利用网络药理学、分子药理学和代谢组学方法,全面展示了蒲公英抗三阴性乳腺癌的多靶点作用机制[80]。这些方法将为进一步更准确寻找、确认和优化蒲公英中发挥抗肿瘤效应的有效成分与靶点的作用关系提供新的见解。此外,目前大多数研究以体外细胞实验为主,研究结果缺乏临床应用性,未来需要大量的体内动物模型深入研究各有效成分抗肿瘤分子作用机制及靶点,以使其能够尽早进入临床,为肿瘤治疗提供新的方法。
来 源:刘晓燕,龙 凤,赵 玉,李 雪,叶海琳,周 旋.蒲公英中有效成分抗肿瘤作用机制的研究进展 [J]. 中草药, 2023, 54(10):3391-3340.
癌症的发病率和死亡率在逐年递增,严重威胁着人类健康与生命。恶性肿瘤常用治疗方法放疗和化疗虽然在一定程度上能抑制肿瘤生长,却无法避免治疗带来的不良反应和耐药性等问题。蒲公英抗肿瘤因其增效减毒作用而备受关注,蒲公英种子提取物能够增强化疗药顺铂对人食管鳞状细胞癌的敏感性[78];蒲公英水提物不仅能够增加肿瘤细胞对化疗药阿霉素的敏感性,而且还能降低阿霉素诱导的心脏毒性[79]。本文总结了蒲公英有效活性成分抗肿瘤的显著疗效,发现蒲公英根提取物及蒲公英中三萜类化合物蒲公英萜醇和蒲公英甾醇抗肿瘤作用研究最为广泛,且对正常细胞及小鼠没有毒性作用,在抗肿瘤药物研发及临床肿瘤治疗或辅助治疗中具有一定的优势和良好的应用前景。本文综述了蒲公英各有效活性成分抗肿瘤潜在分子机制,首先,通过抑制Janus激酶(Janus kinase,JAK)/STAT途径和促进p53表达抑制肿瘤细胞周期进程和细胞增殖;其次,通过线粒体途径和死亡受体途径诱导肿瘤细胞凋亡;此外,通过抑制EMT进程、MMP表达及阻止PI3K/Akt通路来抑制肿瘤细胞迁移和侵袭。蒲公英有效活性成分除了具有诱导细胞凋亡、抑制细胞迁移和侵袭、阻滞肿瘤细胞周期进程、抑制细胞增殖的作用外,还能在调节细胞代谢、诱导细胞自噬、抑制血管生成等方面发挥重要作用。
然而,现阶段蒲公英抗肿瘤研究主要集中在蒲公英根提取物和三萜类化合物,而对其他蒲公英有效活性成分抗肿瘤的作用机制研究较少,且关于蒲公英有效活性成分抗肿瘤的研究大多集中在基础药理机制方面,机制研究上形式较为单一,为了阐明具体抗肿瘤机制,有研究利用网络药理学、分子药理学和代谢组学方法,全面展示了蒲公英抗三阴性乳腺癌的多靶点作用机制[80]。这些方法将为进一步更准确寻找、确认和优化蒲公英中发挥抗肿瘤效应的有效成分与靶点的作用关系提供新的见解。此外,目前大多数研究以体外细胞实验为主,研究结果缺乏临床应用性,未来需要大量的体内动物模型深入研究各有效成分抗肿瘤分子作用机制及靶点,以使其能够尽早进入临床,为肿瘤治疗提供新的方法。
来 源:刘晓燕,龙 凤,赵 玉,李 雪,叶海琳,周 旋.蒲公英中有效成分抗肿瘤作用机制的研究进展 [J]. 中草药, 2023, 54(10):3391-3340.



