马兜铃酸肾病(aristolochic acid nephropathy,AAN)是由马兜铃酸引起的快速进行性肾小管间质性肾炎[1]。短期摄入高剂量的马兜铃酸I可直接损伤近端肾小管上皮细胞,诱导肾组织炎症反应,导致变性、坏死、凋亡,最终发展为终末期肾病[2]。虽然国家限制使用含有马兜铃酸的药物或产品,但仍有新发的AAN病例不断出现。目前临床上,仍没有有效的药物可以逆转马兜铃酸I引起的肾损伤。
中医将AAN归为“关格”“虚劳”等范畴,湿浊证和血瘀证贯穿其始终,是导致病变进行性恶化的主要因素[3]。荆防颗粒[4]是以古方荆防败毒散为处方的现代中成药,其中荆芥、防风、羌活、独活、前胡为祛风胜湿药,可疏风于外、胜湿于内,可祛除肾脏代谢废物;枳壳、川芎可行气活血,改善肾脏微循环;茯苓利湿化浊,甘草补益正气,二者相伍可扶正祛邪,故荆防颗粒不单只用于治疗外感疾病,还可用于治疗内科肾病。对于荆防颗粒用于防治AAN的研究尚未有报道,本研究采用马兜铃酸I建立小鼠AAN模型,探究荆防颗粒对马兜铃酸I引起急性肾损伤的保护作用及其初步机制,为临床应用提供实验依据。
1 材料
1.1 动物
SPF级C57BL/6J雄性小鼠40只,7~8周龄,体质量为20~23 g,购自北京斯贝福生物技术有限公司,合格证号SYXK(京)2020-0033。实验期间动物均饲养于同一环境下,保持室温(25±1)℃,空气湿度55%~65%,12 h光暗循环,自由进食饮水,适应性喂养3 d后进行实验。本实验相关动物实验遵循北京中医药大学有关实验动物管理和使用的规定(动物实验伦理批准号为BUCM-4-2021-092202-3084)。
1.2 药品与试剂
荆防颗粒(批号80022202002)由鲁南制药集团股份有限公司提供;马兜铃酸I(质量分数>98%,批号A800933)购自北京虹湖联合化工产品有限公司;单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)检测试剂盒(批号SEA087Mu)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)检测试剂盒(批号SEA133Mu)、白细胞介素-1β(interleukin-1β,IL-1β)检测试剂盒(批号SEA563Mu)、IL-6检测试剂盒(批号SEA079Mu)均购自武汉云克隆科技股份有限公司;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(批号A001-3-2)、丙二醛(malondialdehyde,MDA)试剂盒(批号A003-1-2)、谷胱甘肽(glutathione,GSH)试剂盒(批号A006-2-1)均购自南京建成生物工程研究所;DAPI(批号G1012)、抗荧光淬灭封片剂(批号G1401)购自武汉赛维尔生物科技有限公司;TUNEL试剂盒(批号11684817910)购自美国Roche公司;BCA蛋白定量试剂盒(批号P0010)购自碧云天生物技术研究所;兔多抗B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2,批号Ab59348)、兔单抗Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax,批号Ab32503)购自英国Abcam公司;兔多抗p53(批号bs1277)购自南京Bioworld公司;兔多抗双微体扩增基因2(murine double minute 2,MDm2,批号bs1277)购自武汉三鹰生物技术有限公司;兔单抗磷酸化蛋白激酶B(phosphorylated protein kinase B,p-Akt,批号4060)购自美国CST公司;小鼠单抗β-actin(批号BM0627)购自武汉博士德生物工程有限公司;HRP标记羊抗小鼠二抗(批号BA1051)和HRP标记羊抗兔二抗(批号BA1054)均购自武汉博士德生物工程有限公司;蒸馏水购自北京拜尔迪生物技术有限公司;去离子水由北京中医药大学科研楼提供。
1.3 仪器
AU-480型全自动生化分析仪(美国Beckman Coulter公司);mμlISKANMK3型酶标仪(美国Thermo Fisher Scientific公司);DYCZ-24DN型垂直电泳槽(北京六一仪器厂);ECLIPSE C1型正置荧光显微镜、DS-U3型成像系统(日本Nikon公司)。
2 方法
2.1分组、造模及给药
C57BL/6J小鼠随机分为对照组、模型组和荆防颗粒高、中、低剂量(16、8、4 g/kg)组,每组8只。各给药组ig相应药物(10 mL/kg),对照组和模型组ig生理盐水,1次/d,持续7 d。第5天给药2 h后,除对照组外,其余各组ip马兜铃酸I(10 mg/kg),连续3 d,建立急性肾损伤模型。末次给药后,小鼠禁食12 h,自由饮水。
2.2 肾功能检测
小鼠摘眼球取血,静置4 h,3500 r/min离心10 min,收集上层血清,采用全自动生化分析仪检测肌酐(creatinine,CRE)和血尿素氮(blood urea nitrogen,BUN)含量。
2.3 炎症因子和氧化应激指标检测
小鼠处死后立即取下肾脏,剥去肾膜,将小鼠右肾在生理盐水中冲洗,用滤纸将水分吸干,加入磷酸盐缓冲液制成10%的组织匀浆液,4000 r/min离心10 min,取上清液,按照试剂盒说明书测定MCP-1、IL-1β、IL-6、TNF-α、MDA、GSH水平及SOD活性。
2.4 肾组织病理学观察
将小鼠左肾固定于4%多聚甲醛溶液中,经梯度乙醇洗脱后,石蜡包埋,以4 μm厚度制作切片,进行苏木素-伊红(HE)染色,于光学显微镜下观察各组小鼠肾组织的病理变化。
2.5 TUNEL法检测肾组织细胞凋亡
取各组小鼠肾组织石蜡切片,用二甲苯脱蜡,梯度乙醇脱水,蒸馏水漂洗再水化,加入蛋白酶K及TUNEL反应混合液,于37 ℃孵育2 h,用DAPI复染细胞核,用荧光显微镜采集图像并拍照。每张幻灯片随机5个视场计数所选区域TUNEL染色的凋亡细胞的数目。
2.6 Western blotting检测p-Akt、MDm2、p53、Bax和Bcl-2蛋白表达
取各组小鼠肾组织,加入含有磷酸酶抑制剂和PMSF的RIPA裂解液,提取总蛋白,使用BCA蛋白定量试剂盒测定蛋白质量浓度。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,于5% BSA中封闭,加入相应一抗,4 ℃孵育过夜;TBST洗涤后,加入二抗,于37 ℃孵育120 min,TBST洗涤3次后,加入ECL发光试剂显色,使用Image J软件分析条带的灰度值。
2.7 统计学处理
采用SPASS 25.0软件对数据结果进行统计并分析,数据结果以表示,多组间差异通过单因素方差分析(ANOVA)进行统计学分析。
3 结果
3.1 荆防颗粒对AAN小鼠肾功能的影响
如表1所示,与对照组比较,模型组小鼠血清中BUN和CRE水平均明显升高(P<0.01);与模型组比较,各给药组小鼠血清中BUN和CRE水平均明显降低(P<0.01)。说明荆防颗粒能够有效缓解马兜铃酸I致小鼠的急性肾损伤。
3.2 荆防颗粒对AAN小鼠肾组织病理变化的影响
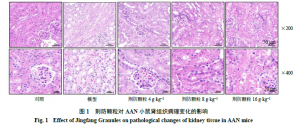
如图1所示,对照组小鼠肾组织未见病理变化;模型组小鼠肾组织受损较严重,出现肾小管扩张或萎缩,部分肾小管上皮细胞脱落、变性坏死,肾间质有炎性细胞浸润、充血水肿,肾小球未出现明显病变;荆防颗粒高剂量组小鼠肾小管扩张、间质扩张水肿明显减轻,炎性细胞浸润明显减少,荆防颗粒中、低剂量组上述病理变化均有一定程度减轻。
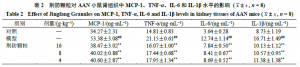
3.3 荆防颗粒对AAN小鼠肾组织炎症因子指标的影响如表2所示,与对照组比较,模型组小鼠肾组织中MCP-1、TNF-α、IL-6及IL-1β水平均明显升高(P<0.01);与模型组比较,各给药组小鼠肾组织中MCP-1、TNF-α、IL-6及IL-1β水平均显著降低(P<0.01)。
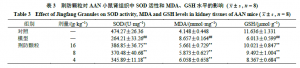
3.4 荆防颗粒对AAN小鼠肾组织氧化应激指标的影响如表3所示,与对照组比较,模型组小鼠肾组织中MDA水平明显升高(P<0.01),SOD活性和GSH水平均显著降低(P<0.01);与模型组比较,各给药组小鼠肾组织中MDA水平显著降低(P<0.01),SOD活性及GSH水平显著升高(P<0.01)。
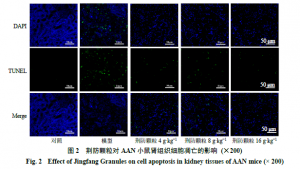
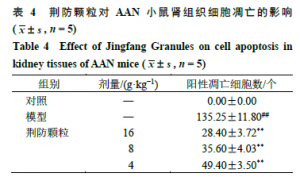
3.5 荆防颗粒AAN小鼠肾组织细胞凋亡的影响如图2所示,细胞核经过DAPI复染后在紫外的激发下为蓝色,阳性凋亡细胞核为绿色。如表4所示,与对照组比较,模型组凋亡的肾小管上皮细胞数目明显增多(P<0.01);与模型组比较,荆防颗粒各剂量组凋亡的阳性细胞数目明显减少(P<0.01),且呈剂量相关性。
综上所述,本研究证实荆防颗粒能够预防和改善马兜铃酸I引起的小鼠急性肾损伤,主要通过抑制炎症反应,降低肾脏中炎症细胞因子MCP-1、TNF-α、IL-1β和IL-6水平,升高GSH水平和SOD活性,降低MDA水平,激活Akt/MDm2/p53通路改善凋亡相关蛋白的表达,从而发挥抗氧化、抗凋亡和抗炎作用。3.6 荆防颗粒对AAN小鼠肾组织Akt/MDm2/p53通路相关蛋白表达的影响如图3和表5所示,与对照组比较,模型组小鼠肾组织中p53、Bax蛋白表达水平显著升高(P<0.01),p-Akt、MDm2和Bcl-2蛋白表达水平均显著降低(P<0.01);与模型组比较,各给药组小鼠肾组织中p53、Bax蛋白表达水平显著降低(P<0.01),p-Akt、MDm2和Bcl-2蛋白表达水平均显著升高(P<0.01)。
4 讨论
马兜铃酸是一种硝基菲羧酸的天然化合物,常见于细辛属、马兜铃属等马兜铃科植物中[5]。含马兜铃酸的中药及中成药广泛应用于临床,存在显著的药理活性[6]。作为马兜铃酸的主要成分之一,马兜铃酸I的肾毒性已经被广泛认识,为此许多含马兜铃酸I的中草药被减毒处理、采用其他中药来替代使用甚至禁用[2,6]。但这些措施仍无法彻底避免AAN发生,使得中药安全使用遇到重大阻碍。目前在临床中,还未建立起应对AAN的长期稳定有效的用药方案,大部分药物研究仍停留在动物模型实验阶段,如丹参酮I[7]、17β-雌二醇[8]和环螺旋B肽[9]等。
中医认为AAN的主要病机为“湿浊内蕴,痰瘀互阻”,故治疗以利湿化浊、益气活血为主。温病学家赵绍琴教授提出的疏风胜湿法、分消利湿法、益气培元法对AAN的治疗具有重大的指导价值[10-11]。荆防颗粒组方源自《摄生众妙方》中的荆防败毒散[12],古人以治四时外感为主,经过历代医家的拓展运用,现今已应用于各科疾病的治疗[13-15]。荆防败毒散治疗肾病近年来已有相关报道[16-17],方中以荆芥、防风相伍为君,以驱散一切外受风邪;羌活、独活合用可除周身上下之寒湿;柴胡、前胡相配,一升一降,一疏一散,可调人体内外之气机;桔梗、枳壳相伍,升降相因,宣散有度,可通调三焦;川芎、茯苓可气血水同治,川芎行气活血,茯苓利水渗湿,二者可相伍则气、血、水通行三焦,周身气血运行无阻。药理学实验证实,方中大部分药物具有抗炎、抗氧化、抗凋亡的作用[18-20]。
本实验通过连续3 d ip马兜铃酸I(10 mg/kg)成功建立马兜铃酸I致小鼠急性肾损伤模型,结果显示,与对照组比较,模型组小鼠血清中CRE、BUN水平显著升高,表明小鼠肾功能出现损伤。同时小鼠肾组织病理切片显示,模型组小鼠肾组织出现部分肾小管上皮细胞脱落、变性坏死,肾间质有炎性细胞浸润、充血水肿等病变特征。从基因水平来看,相关研究已经证实马兜铃酸I所致急性肾损伤可引起kap、Spp1、Aldh1a2、Serpine1、Tnc等基因的差异表达[21]。kap为肾脏雄激素调节蛋白,可保护肾小管细胞免受毒素的损伤;Spp1是一种细胞外基质趋化因子样磷酸糖蛋白,与免疫调节、肿瘤发生和细胞信号传导相关;Aldh1a2参与肾脏发育过程中内源性全反式维甲酸的合成,而内源性全反式维甲酸与细胞增殖、分化以及凋亡密切相关;Serpine1被发现与癌症病变相关;Tnc是一种大分子细胞外基质糖蛋白,参与调节细胞的黏附、扩散、迁移和增殖,上述5种差异基因在炎症信号通路、过氧化反应、糖代谢等途径中富集明显。本研究探索了荆防颗粒对马兜铃酸I致小鼠肾损伤的药理作用以及潜在机制,结果发现模型小鼠经过不同剂量的荆防颗粒预给药后,肾组织破坏程度以及炎性细胞浸润情况均得到了不同程度的改善。炎症反应与AAN发病机制密切相关[22]。AAN主要引起肾小管上皮细胞的DNA损伤,从而导致炎性细胞浸润、趋化因子的分泌、细胞周期停滞和细胞凋亡[23]。MCP-1是炎症反应中重要的趋化因子,对单核/巨噬细胞具有特异性趋化激活作用。同时巨噬细胞能够分泌TNF-α、IL-1β、IL-6等促炎因子,诱导核因子-κB(nuclear factor kappa-B,NF-κB)活化和NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)炎症小体相关蛋白表达[24-25],进而导致炎症和组织损伤。本研究结果显示,荆防颗粒各剂量组均能明显降低大鼠血清中MCP-1、TNF-α、IL-1β和IL-6的水平,表明荆防颗粒能够在一定程度上抑制炎症细胞因子的分泌,从而发挥减轻急性肾损伤的作用。
多项研究证明,氧化应激是马兜铃酸I发挥细胞毒性的重要机制[26-27]。AAI通过激活丝裂原活化蛋白激酶/细胞外调节蛋白激酶1/2(mitogen activated protein kinase/extracellular regulated protein kinases 1/2,MEK/ERK1/2)信号通路[28],诱导肾组织细胞内活性氧(reactive oxygen species,ROS)含量增加,破坏机体自由基生成与清除的动态平衡,造成氧化应激损伤[29]。MDA作为脂质过氧化反应生成的终末产物之一,可破坏细胞膜结构,其水平升高提示氧化/抗氧化系统失衡,可间接反映肾脏组织过氧化程度。SOD和GSH是体内重要的抗氧化酶和自由基清除剂,能够维护细胞稳态,避免氧化损伤。结果显示,AAI显著升高肾组织中MDA水平,同时降低SOD活性和GSH水平,表明肾组织脂质过氧化受损严重;经过各剂量荆防颗粒预给药后,可显著提高SOD活性和GSH水平,同时降低MDA水平。表明荆防颗粒能够提高机体抗氧化能力,清除自由基,减轻AAI导致的肾损伤。细胞凋亡是马兜铃酸I诱导肾小管上皮细胞病理损伤的主要机制[30],
已有多项研究表明激活磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinase,PI3K)-蛋白激酶B(protein kinase B,Akt)通路对AAN引起的细胞凋亡过程有抑制作用[31-33]。PI3K与表皮生长因子(epidermal growth factor,EGF)结合活化后,使下游靶蛋白Akt磷酸化,从而激活或抑制下游一系列底物,对促进细胞存活、生长、增殖和血管生成中发挥重要作用[34]。p53是PI3K/Akt下游的重要基因,研究表明马兜铃酸I可刺激其过表达诱导细胞周期停滞并促进细胞凋亡[35]。MDm2作为PI3K/Akt通路中的重要一环,主要负责调控下游p53蛋白在氧化应激情况下的表达状况[36]。当细胞DNA受损或暴露于各种代谢应激时,p53蛋白转录活性大大增加。此时Akt磷酸化可以促进转录因子MDm2的稳定化和核转位,与p53形成复合物,阻断转录作用的功能,从而引发p53的泛素化和降解[37]。MDm2-p53信号有助于p53功能在细胞应激反应停止后恢复到正常的稳态水平[38]。结果显示,模型组小鼠肾组织p53以及凋亡相关蛋白Bax表达水平显著升高,p-Akt、MDm2蛋白表达受到抑制;经过荆防颗粒预给药处理后,可明显提高p-Akt、MDm2以及抗凋亡蛋白Bcl-2的表达,抑制p53表达。TUNEL染色结果也表明荆防颗粒预处理能够显著抑制马兜铃酸I诱导的小鼠肾组织细胞凋亡。
另一方面,细胞内过度产生的ROS能通过破坏DNA、蛋白质、细胞膜或线粒体等细胞成分而引发细胞凋亡,这主要通过与Bcl-2家族蛋白相关的线粒体途径实现[39]。Bcl-2和Bax都是p53蛋白的转录靶点,在DNA损伤时诱导细胞周期阻滞或凋亡[40]。Bcl-2表达提高有利于增强细胞的抗凋亡功能,而Bax的增加则促进细胞凋亡。Bax/Bcl-2值通常用来表示细胞凋亡水平[41]。本研究发现,与对照组比较,模型组小鼠肾组织促凋亡蛋白(p53、Bax)表达上调,抗凋亡蛋白Bcl-2表达下调。而荆防颗粒组可显著促进p-Akt、MDm2蛋白表达来抑制p53,从而改变Bax/Bcl-2值。表明荆防颗粒通过调节线粒体凋亡通路和Akt/MDm2/p53信号通路相关蛋白的表达,抑制了马兜铃酸I诱导的肾细胞凋亡。
利益冲突 所有作者均声明不存在利益冲突
来 源:曹天佑,屈会化,董利洋,程国良,姚景春,孙成宏,赵 琰,张贵民.荆防颗粒对马兜铃酸I致小鼠急性肾损伤的预防和保护作用研究 [J]. 中草药, 2022, 53(18):5742-5749 .