2022-05-01 08:46
何首乌是蓼科植物何首乌Polygonum multiflorum Thunb.的干燥块根,由于其生品有小毒,临床上多以其炮制品——制首乌入药。制首乌性温,味甘涩,归肝、肾经,具有补肾乌须、补益精血等功效[1],为著名的滋补类中药。近年来,国内外不断出现含制首乌的相关复方、制剂导致肝、肾毒性的报道[2-5],引起了相关部门和科研工作者的高度关注。有学者认为其原因可能与其近现代炮制方法的改变有关。有研究者对其“九蒸九晒”炮制工艺进行了大量研究,也证实了“九蒸九晒”对何首乌的肝毒性有明显的减毒作用[6-12]。然而,此前的研究主要集中于“九蒸九晒”炮制工艺过程中化学成分的变化和不同蒸制次数对肝毒性的影响,却很少有研究探索“九蒸九晒”法对何首乌致肾毒性的影响。其中的主要原因之一可能与肾毒性产生的生物标志物丰度较低,因此难于检测有关。
随着科学技术的快速发展,分析生物标志物已经成为了解和分类疾病发病机制的一类多学科方法。由于蛋白质的多样性,且对蛋白质的测定具有易出现假阳性、费时、需要专门仪器等诸多缺点,因此基于蛋白质类生物标志物的评估往往具有一定的挑战性。相反,参考理想标志物的规定,细胞外miRNA符合标准[13]:miRNA在不同的体液中可以被轻易获取;miRNA可以保持很高的稳定性;miRNA序列在物种间具有高度的保守性;miRNA与特定组织或病理状态相关。
迄今为止,在肾脏的毒性生物学标志物探索方面,针对miRNA的工作非常注重于对尿液的研究,因为它直接衍生自肾脏,并且尿液研究是一种非侵入性的研究方法。此外,由于胞外miRNA在物种间的高度保守性和在体液中容易取样的便捷性[14],细胞外的miRNA作为生物学标志物在药物研发中具有更多的优势:科学家们研究在细胞培养液中存在着的miRNA主要表现在探索其在细胞间通讯联系中的潜在作用,miRNA可以从受损伤的肾脏细胞中被释放出来,因此,经药物诱导损伤的细胞和未经药物处理的正常细胞的培养基具有不同的miRNA谱[15]。研究发现,miR-21的表达与肾小球和肾小管间质的肾脏发病密切相关,而肾小管细胞坏死是药物性肾损伤的主要发病机制之一,miR-21在整个过程中发挥着重要的转录后调控作用[16-17],同时,在患有急性肾损伤的病患的尿液中miR-21和miR-200c的表达显著增加;使用造影剂泛亚氨酸处理原代近端肾小管上皮细胞后,细胞培养基中miR-21、miR-200c和miR-423的表达显著增加[18],可以看出,miR-21和miR-200c与药物性肾损伤有着密切的联系,其参与肾组织损伤的调节,是近年来被发现的药物性肾损伤相关的新型生物标志物[19]。
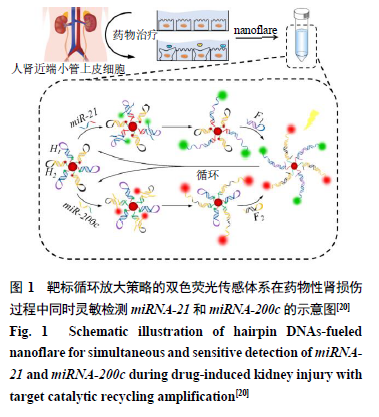
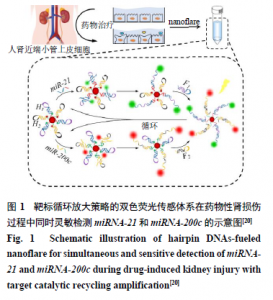
本课题组前期已建立一种靶标循环放大策略的双色荧光传感体系nanoflare用于对miR-21和miR-200c的荧光检测[20]。如图1所示,纳米金颗粒(Au nanoparticles,AuNPs)被分别用FAM和Cy5标记的DNA发卡检测链H1和H2功能化,DNA发卡检测链H1和H2分别设计用于响应miR-21和miR-200c。在没有靶标miRNAs存在的情况下,由于分子内杂交的阻滞,在AuNPs上修饰的DNA发卡检测链(H1和H2)和DNA发卡燃料链(F1和F2)保持完整,并且染料FAM和Cy5的荧光被AuNPs淬灭,此时,几乎没有荧光背景。相反,当用肾毒性药物刺激人肾近端小管上皮细胞(renal proximal tubule epithelial cells,RPTEC)时,miRNAs分泌到细胞外的环境中,一旦双色荧光传感体系nanoflare遇到互补的miRNAs靶标,即细胞经刺激分泌出的miR-21和miR-200c,则杂交双链H1-miR-21和H2-miR-200c将会形成,从而产生用于miRNAs检测的FAM和Cy5的双色荧光。在DNA发卡检测链和靶标miRNAs杂交后,DNA发卡燃料链将与单链DNA发卡检测链暴露出的黏性末端完美配对,从而形成更稳定的杂交双链体,并且目标物miRNAs可以释放以进行下一步结合,从而实现靶标循环扩增检测。与化学反应中的催化剂相似,目标物miRNAs在整个过程中引发了循环扩增反应的开始,同时又完好地从反应中离开,起到了“催化”的作用。因此,该双色荧光传感体系nanoflare可以以1∶n的信号输出而不是1∶1的等效反应比响应miRNAs,可以成功地用于检测和评估药物诱导的损伤的肾细胞中低丰度的miRNAs。
本研究旨在探讨经“九蒸九晒”炮制后的制首乌水提物对肾细胞的毒性,通过使用所建立的双色荧光传感体系测定肾细胞分泌的miR-21和miR-200c的表达,观察经炮制后的制首乌对肾细胞的毒性作用。
1 材料
1.1 细胞
RPTEC购自美国ATCC。
1.2 药材
生何首乌样品(S0)产地为广东德庆,年份为2019,经戚进教授鉴定为蓼科植物何首乌P. multiflorum Thunb.的干燥块根
1.3 药品与试剂
无菌PBS溶液(批号KGB50)、胰蛋白酶(批号KGY0012)、DMEM/F12高糖培养基(批号KGM12500H-500)、MTT细胞增殖和细胞毒性测定试剂盒(批号KGA311)购自南京凯基生物科技发展有限公司;胎牛血清(批号F2442)购自美国Sigma公司;PureZOL RNA分离试剂(批号7326880)购自美国Bio-Rad公司;miRNA 1st Strand cDNA SynthesisKit(批号MR101-02)、miRNA Universal SYBR qPCR MasterMix(批号MQ101-02)购自南京诺唯赞生物科技有限公司;其他试剂均为市售分析纯。
1.4 仪器
L-80XP型超高速冷冻离心机、Allegra 64R型高速离心机(美国贝克曼库尔特科学仪器);低速离心机(长沙湘智离心机仪器有限公司);EL-x800型酶标仪(美国Bio Tek公司);Milli-Q超纯水仪(美国Millipore公司);细胞培养箱、超低温冰箱(美国Thermo Fisher Scientific公司);恒温水浴锅(常州国华电器有限公司)。
2 方法
2.1 不同炮制次数制首乌水提物对细胞毒性的影响
本课题组前期已对生何首乌(S0)完成了从“一蒸一晒”(S1)到“十二蒸十二晒”(S12)的不同次数的炮制,晒蒸的方法参照《中国药典》2020年版一部(通则0213),每次实验严格控制操作的温度和时间。本研究使用的是不同炮制次数制首乌的水提物。将不同炮制次数的制首乌水提物分别用无胎牛血清的DMEM/F12培养基稀释成终质量浓度为1、2、5、10、20、50、100 mg/mL的溶液,经0.22 μm微孔滤膜滤过备用。
RPTEC用含20%胎牛血清的DMEM/F12高糖培养基,于37 ℃、5% CO2进行常规培养。取处于对数生长期的细胞,以1×104/孔接种于96孔板中,每孔200 μL,培养24 h;弃去培养液,分别加入200 μL已配制好的生首乌(S0)和不同炮制次数(S1~S12)制首乌水提物(终质量浓度分别为1、2、5、10、20、50、100 mg/mL)培养24 h,对照组加入不含药物的培养基,在96孔板上留出一列不接种细胞,作为调零孔(即空白组),并且每种药物在每个质量浓度下设置至少5个复孔;使用MTT活细胞检测系统对生首乌和不同炮制次数制首乌水提物处理下的RPTEC活力进行检测,计算细胞存活率,MTT工作液质量浓度为5 mg/mL,使用Origin 2018软件绘制质量浓度-细胞存活率曲线。
细胞存活率=(A实验-A空白)/(A对照-A空白)
2.2 细胞培养基中总RNA的提取
RPTEC以1×107/孔接种于6孔板中,每孔2 mL,培养24 h;弃去培养液,分别用不同炮制次数制首乌水提物(20 mg/mL)孵育24 h,对照组加入不含药物的培养基,取500 μL上清液,与1 mLPureZOL试剂混合置于RNase-free离心管中,孵育5 min;加入氯仿后充分摇动RNase-free离心管,离心分离上层水相,并将其收集到新的RNase-free离心管中;将异丙醇添加到水相中混合5 min,4 ℃、12 000×g离心10 min;将RNA沉淀物用75%乙醇洗涤,4 ℃、7500×g离心5 min;吸去乙醇,将纯化的RNA重新悬浮于50 µL DEPC水中。
2.3 双色荧光传感体系检测制首乌诱导肾细胞损伤后miRNAs
取50 μL“2.2”项下提取出的细胞培养基中的总RNA,与5 nmol/L双色荧光传感体系nanoflare在200 μL的总体积中于37 ℃孵育1 h,待反应溶液冷却至室温时,使用荧光酶标仪检测反应后的恢复的荧光信号强度,通过492 nm波长的激发光激发,收集发射图谱中518 nm波长出的FAM的荧光强度数据,荧光发射收集范围为500~660 nm;通过648 nm波长的激发光激发,收集发射图谱中668 nm波长出的Cy5的荧光强度数据,荧光发射收集范围为650~760 nm。
2.4 qRT-PCR实验
使用miRNA 1stStrand cDNA Synthesis Kit逆转录cDNA样品。在RNase-free离心管中配制混合液:2 μL 5×gDNA Wiper Mix和8 μL已提取的RNA样品,吹打均匀后于42 ℃孵育2 min;加入1 μL 2 μmol/L stem-loop primer,2 μL 10×RT Mix,2 μL HiScript II Enzyme Mix和5 μL RNase-free ddH2O,分别依次在25 ℃、5 min,50 ℃、15 min和85 ℃、5 min下进行孵育;产物即为所合成的cDNA链,可立即用于qRT-PCR反应,或保存在−20 ℃中用于随后的实验。使用miRNA Universal SYBRqPCR Master Mix对逆转录出的cDNA链进行qRT-PCR分析,使用2−∆∆Ct法计算经不同炮制次数制首乌处理的RPTEC中miR-21和miR-200c的相对表达量。引物序列见表1。
2.5 统计分析
通过Origin 2018软件对数据进行处理分析,数据以表示,多组间比较采用的是单因素方差分析的方法。
3 结果
3.1 不同炮制次数制首乌水提物对肾细胞毒性的影响
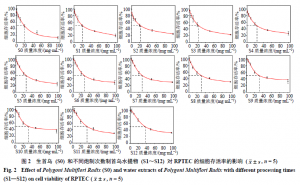
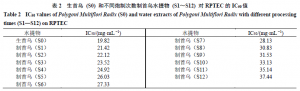
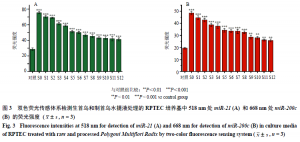
本研究通过给予细胞生首乌(S0)和经过12次蒸晒炮制次数(S1~S12)的制首乌水提物,考察以上各水提物对肾细胞的半数抑制浓度(halfinhibitory concentration,IC50),初步评价肾细胞系用于体外药物诱导的肾毒性研究的可行性,并根据在生首乌和不同炮制次数制首乌水提物处理下的肾细胞的凋亡情况,确定接下来实验中所使用的水提物质量浓度。生首乌和不同炮制次数制首乌水提物与肾细胞孵育24 h后,计算不同质量浓度下肾细胞的存活率,使用Origin 2018软件进行拟合,绘制肾细胞的生存曲线(图2),得到生首乌和不同炮制次数制首乌水提物对RPTEC的IC50值(表2),随着何首乌炮制次数的增加,其水提物对肾细胞的IC50值不断增加,反映出水提物的毒性不断下降。选择20 mg/mL的水提物进行后续实验,使用已经合成的双色荧光传感体系nanoflare对生首乌和不同炮制次数制首乌水提物诱导的肾细胞损伤后的靶miR-21和miR-200c的表达进行研究。
3.2 双色荧光传感体系用于肾细胞损伤后miRNAs分析
如图3所示,在使用生首乌(S0)和经过12次蒸晒炮制次数(S1~S12)的制首乌水提物处理后的细胞培养基中,双色荧光传感体系可以很明显检测到所提取的miR-21和miR-200c表达有不同程度地升高;随着何首乌炮制次数的增加,FAM和Cy5 2种荧光的恢复强度在不断减弱,表明其水提物处理后的细胞培养基中的miR-21和miR-200c的含量在不断减少。并且相比于没有用药物处理过的正常RPTEC,经水提物处理后的RPTEC分泌的miR-21和miR-200c的表达整体偏高;同时,观察到在超过9次炮制次数后,FAM和Cy5 2种荧光的恢复强度的减弱程度减缓,说明炮制超过9次后的制首乌(S9~S12)的毒性减弱的程度相当,也表明双色荧光传感体系可以准确地区分正常细胞和经药物诱导的细胞。
3.3 qRT-PCR分析
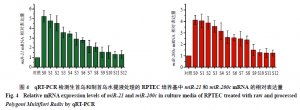
使用qRT-PCR检测miR-21和miR-200c表达的变化,对上述检测结果的准确性进行验证。如图4所示,经生首乌和不同炮制次数制首乌水提物处理的RPTEC培养基中的miR-21和miR-200cmRNA相对表达量出现了不同程度地变化,总体而言,测得的miR-21和miR-200c的表达水平与双色荧光传感体系所检测的结果对应。
4 讨论
中药炮制是按临床用药需求及药物自身性质,采用一定的方法将中药材加工成中药饮片的技术,“九蒸九晒”是中药材处理中比较常见的炮制手段,常用于何首乌、黑芝麻、地黄、黄精等药材的处理,从宋代伊始沿用至清代,人们通过使用“九蒸九晒”的方式减小中药材对人体的毒性[21]。而其中的“九”,除了有“九次”的含义之外,在古语中还泛指“多次”,何首乌是典型的生熟异治的药材,本研究基于对何首乌传统炮制方法的考证,针对“九蒸九晒”这一具有特色的炮制方法,研究何首乌炮制过程中毒性的演变规律;同时,关于何首乌的研究主要集中在其对于肝脏的毒性方面,本研究创新性使用新型纳米材料纳米金与核酸组装的双色荧光传感体系,针对经过“九蒸九晒”炮制后的制首乌水提物对肾细胞的毒性进行了检测,通过使用所建立的双色荧光传感体系测定药物性肾损伤相关生物标志物miR-21和miR-200c的表达,观察经炮制后的制首乌对肾细胞的毒性作用,考察了何首乌经炮制后的肾脏毒性,为具有潜在肾毒性药物的筛选及机制研究和临床安全用药的指导提供了新的方法。
在本课题组的前期工作中,通过构建不同肾毒性药物的肾细胞体外模型,证明了在肾毒性药物诱导肾细胞损伤后,细胞培养基中的miR-21和miR-200c的表达出现了不同程度地增加;本研究通过使用所建立的双色荧光传感体系测定肾细胞分泌的miR-21和miR-200c的表达,观察经炮制后的制首乌对肾细胞的毒性作用。首先使用生首乌水提物和本课题组前期已完成“一蒸一晒”(S1)到“十二蒸十二晒”(S12)的不同次数的炮制的制首乌水提物建立肾细胞体外模型,并且根据质量浓度-细胞存活率曲线,选择合适的给药质量浓度;其次,使用双色荧光传感体系nanoflare成功对给药前后细胞培养基中的miR-21和miR-200c进行定量检测,发现伴随着炮制次数的增加,培养基中测得的miR-21和miR-200c的表达均在一定程度上减少,同时观察到在超过9次炮制次数后,miR-21和miR-200c的表达没有显著性变化。通过比较不同炮制次数的何首乌水提物的肾细胞毒性,可知在炮制过程中毒性逐渐减弱,炮制至第9次时毒性显著减弱,其后随着炮制的再进行,对肾细胞的毒性作用变化不大,基本趋于稳定。通过结合qRT-PCR技术对肾毒性生物标志物miR-21和miR-200c的测定,在炮制9次之后,miR-21和miR-200c的表达接近对照组水平,对于何首乌“九蒸九晒”炮制品对肾小管的毒性仍需进一步研究。生首乌毒性很强,而通过“九蒸九晒”后的制首乌基本无毒,表明通过“九蒸九晒”在细胞水平可以达到减毒的作用,未来有望进一步用于活体实验进行探讨,以上研究结果可以为制首乌炮制工艺与质量标准的完善提供一定的参考。
本研究将双色荧光传感体系用于探究以炮制后的制首乌为代表的中药材对肾细胞的毒性作用,旨在探索经炮制处理后的中药材的毒性变化,因双色荧光传感体系的检测具有普适性,有望用于更多具有潜在肾毒性药物的筛选及机制的研究中;创新性使用现代新型纳米材料AuNPs,结合荧光检测技术,发展无创、高灵敏、快速响应的荧光传感器,实现了对何首乌经不同炮制后毒性变化的快速识别;同时,以生首乌和不同炮制次数制首乌的水提物作为模型药物,可以为更多中药材在炮制过程中的毒性演变规律研究提供新的方向。
利益冲突 所有作者均声明不存在利益冲突
参考文献(略)
来 源:高 涵,刘史佳,庞会明,田蒋为,戚 进.基于靶标循环放大策略的双色荧光传感体系探索何首乌“九蒸九晒”炮制过程中不同蒸制次数对肾细胞的减毒作用 [J]. 中草药, 2022, 53(8): 2383-2389 .