据国际糖尿病联盟最新报告,2021年全球糖尿病患者已达5.37亿人,平均每10人中就有1人为糖尿病患者[1]。目前,多达25%的糖尿病患者一生面临慢性不愈合伤口的风险,如糖尿病足溃疡(diabetic foot ulcers,DFUs)使患者面临截肢的风险,这其中有至少68%的患者会在5年内死亡[2]。大量的研究表明,氧化应激在阻止糖尿病患者创面愈合进程中扮演着重要角色[3-4]。糖尿病创面氧化应激的特点是创面局部活性氧(reactive oxygen species,ROS)水平显著升高,这是由于ROS的生成途径增加以及ROS的清除机制发生紊乱[5]。适度的氧化应激已被证明有利于细胞外基质(extracellularmatrix,ECM)的生成,而高水平的ROS会阻碍ECM的正常合成,并且对已经存在的ECM产生一系列损害,从而导致糖尿病伤口迁延难愈[6-7]。核因子E2相关因子2(nuclear factor erythroid-2 relatedfactor 2,Nrf2)是细胞防御多种应激损伤的关键因子,在生理条件的ROS刺激下,Nrf2发生磷酸化反应被激活,进而启动其下游调节蛋白血红素氧合酶-1(heme oxygenase-1,HO-1)共同清除ROS。但是不受控的、过量生成的ROS导致氧化应激,从而抑制Nrf2的激活,损害细胞功能,促进多种疾病的发生发展。因此抗氧化应激,促进Nrf2、HO-1的激活表达,成为改善糖尿病伤口迁延难愈的有效方法。
白虎加人参汤出自东汉张仲景所著《伤寒杂病论》,是治疗消渴病的经典名方。大量临床应用及本课题组前期研究表明,白虎加人参汤具有降血糖、抗炎、抗氧化应激、保护胰岛β细胞等作用,可有效改善糖尿病、延缓相关并发症的发生发展[8-10]。本研究以链脲佐菌素(streptozotocin,STZ)干预、耐甲氧西林金黄色葡萄球菌(methicillin-resistantstaphylococcus aureus,MRSA)感染的骨骼肌特异性胰岛素样生长因子-1受体功能缺失(loss of skeletalmuscle-specific insulin-like growth factor-1 receptor function,MKR)小鼠为研究对象,探讨白虎加人参汤对MKR小鼠糖代谢、氧化应激、创面愈合等方面的作用,并且进一步探讨了白虎加人参汤对Nrf2/HO-1通路表达的影响,为糖尿病创面感染治疗及白虎加人参汤的临床应用提供了新思路。
1 材料
1.1 动物与菌株
SPF级雄性MKR小鼠,体质量(17±2)g,6周龄,由美国国立卫生研究院糖尿病研究中心提供,饲养于湖南中医药大学SPF级实验动物中心[SYXK(湘)2013-0005]。SPF级雄性FVB/N小鼠,6周龄,体质量(17±2)g,购自北京斯贝福生物技术公司[SCXK(京)2019-0010]。小鼠被安置于标准化动物房中,自由进食饮水。所有动物实验均根据湖南中医药大学实验动物护理和使用指南执行,经湖南中医药大学第一附属医院实验动物伦理委员会批准(批准号ZYFY20201229)。
MRSA标准菌株ATCC43300由湖南大学生物学院刘斌教授与童春义教授课题组惠赠。
1.2 药材
白虎加人参汤组方药材石膏(批号SAO247)、知母(批号202106150)、人参(批号210429)、炙甘草(批号210502)饮片购自湖南中医药大学第一附属医院门诊中药房,粳米为市售。经湖南中医药大学药学院吴勇军副教授鉴定分别为硫酸盐类矿物石膏族石膏、百合科植物知母Anemarrhena asphodeloidesBge.的干燥根茎、五加科植物人参Panax ginseng C. A. Mey.的干燥根和根茎、豆科植物甘草Glycyrrhiza uralensis Fisch.的干燥根和根茎的炮制品、禾本科植物稻Oryza sativa L.的干燥种子,符合《中国药典》2020年版规定。
1.3 药品与试剂
盐酸二甲双胍片(国药准字H44024853,批号2012008,0.25 g/片)购自深圳市中联制药有限公司;小鼠胰岛素ELISA检测试剂盒(批号210415)购自上海碧云天公司;糖化血清蛋白(glycated serum protein,GSP)测定试剂盒(批号20210317)购自南京建成生物工程研究所有限公司;小鼠C肽ELISA试剂盒(批号210218)购自上海酶联生物科技有限公司;STZ(批号20210316)、超氧化物歧化酶(superoxide dismutase,SOD)活性检测试剂盒(批号S8211)、过氧化氢酶(catalase,CAT)活性检测试剂盒(批号C3209)、谷胱甘肽过氧化物酶(glutathion peroxidase,GPx)活性检测试剂盒(批号G5174)购自北京索莱宝科技有限公司;白细胞介素-6(interleukin-6,IL-6)检测试剂盒(批号F26031595)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)检测试剂盒(批号F27031596)、IL-1β检测试剂盒(批号G13031594)购自武汉华美生物公司;Nrf2抗体(批号12721)购自美国CST公司;HO-1抗体(批号27282-1-AP)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphatedehydrogenase,GAPDH)抗体(批号10494-1-AP)、HRP标记的山羊抗兔IgG抗体(批号SA00001-2)购自美国ProteinTech公司;多聚甲醛固定液、苏木素-伊红(hematoxylin-eosin,HE)染液购自武汉赛维尔生物科技有限公司。
1.4 仪器
GA-3型血糖仪(三诺生物公司);5418R/5702R型高速冷冻离心机(湖南湘仪实验室仪器开发有限公司);EnSpire2300型多功能酶标分析仪(新加坡PerkinElmer公司);8000型电热恒温培养箱(美国Thermo Scientific公司);DYY-6C型电泳仪(中国北京六一公司);DYCZ-40D型转膜系统(中国北京六一公司);YP1002N型电子天平(上海精密科学仪器有限公司);JSM-6700F型扫描显微镜(日本JEOL公司)。
2 方法
2.1 白虎加人参汤的制备
白虎加人参汤根据《伤寒杂病论》记载,按照现代剂量换算,参照普通高等教育“十五”国家级规划教材《方剂学》,取知母18 g、石膏50 g、人参10 g、炙甘草6 g、粳米9 g。以8倍量蒸馏水浸泡上述药物30 min,煎煮30 min,药液留存待用;投入6倍量蒸馏水再次煎煮30 min,合并2次水煎液,滤过残渣,通过旋转蒸馏仪浓缩为含生药量4 g/mL浓缩液,分装保存于4 ℃备用。经高效液相色谱法测定,提取物中含钙离子7.03%、知母多糖3.82%、芒果苷2.09%、人参总皂苷0.36%、甘草酸0.17%[8,11]。
2.2 菌液的制备
MRSA菌株接种于新鲜LB培养基中,在37 ℃细菌培养箱中培养24 h。选对数生长期阶段挑取单个生长良好的菌落,加入0.85%无菌生理盐水震荡混匀,使用浊度仪调整菌液浓度为1×108CFU/mL,保存于4 ℃备用。
2.3 分组、造模与给药
20只6周龄雄性MKR小鼠,ip STZ溶液(40 mg/kg,用pH 4.0柠檬酸-柠檬酸钠缓冲液制备,现用现配),连续5 d;通过尾静脉采血测量空腹血糖(fasting blood glucose,FBG),FBG≥11.1 mmol/L的小鼠纳入实验。小鼠ip 0.3%戊巴比妥钠溶液(0.1 mL/g)麻醉后,用脱毛膏脱去背部毛发,于无菌条件下,在背部中心制备直径约为13mm的圆形全层创面,随后在小鼠伤口上滴加100 μL MRSA悬液,连续感染2 d后,创面红肿,分泌黄白色脓液,用无菌棉签蘸取创面渗出液进行平板实验可见大量MRSA,提示创面感染模型建立成功[12-13]。
按照随机数字表法将20只创面感染模型小鼠随机分为模型组、二甲双胍(0.11 g/kg)组和白虎加人参汤低、高剂量(14、28 g/kg,分别相当于临床1、2倍剂量)组,每组5只。取5只6周龄雄性FVB/N小鼠,适应性喂养1周,制备背部创面并感染后,作为对照组。各给药组ig相应药物(10 mL/kg),对照组和模型组ig等体积蒸馏水,1次/d,连续12 d。各组小鼠背部创面以无菌纱布覆盖加创可贴固定,每日更换干净纱布与创可贴。
2.4 白虎加人参汤对STZ/MRSA MKR小鼠体质量的影响
给药第0、4、8、12天,使用小动物体质量秤记录各组小鼠空腹体质量。
2.5 白虎加人参汤对STZ/MRSA MKR小鼠伤口变化的影响
在给药第0、4、8、12天,对小鼠背部感染创面拍照记录,使用游标卡尺测量创面的大小变化,并计算创面面积(S)。
S=π×a×b
S为创面面积(mm2),a为创面长轴/2,b为创面短轴/2
2.6 白虎加人参汤对STZ/MRSA MKR小鼠糖代谢的影响
给药第0、4、8、12天,使用血糖仪经尾静脉采血,测量各组小鼠FBG;末次给药后,通过眼眶采血,得到血清后按照试剂盒说明书测定小鼠血清胰岛素、血清C肽、糖化血清蛋白水平。
2.7 白虎加人参汤对STZ/MRSA MKR小鼠全身性炎症水平的影响
末次给药结束后,通过眼眶采血获得血清后,按照试剂盒说明书测定小鼠血清TNF-α、IL-1β和IL-6水平。
2.8 白虎加人参汤对STZ/MRSAMKR小鼠全身性氧化应激水平的影响
末次给药结束后,通过眼眶采血获得血清后,按照试剂盒说明书测定小鼠血清SOD、CAT和GPx活性。
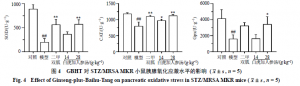
2.9 白虎加人参汤对STZ/MRSAMKR小鼠胰腺氧化应激水平的影响
末次给药结束后,获得新鲜的胰腺组织,剪取适量组织放入液氮速冻,后转入−85 ℃保存,临用前加入10倍体积提取液进行冰浴匀浆;4 ℃、10 000 r/min离心10 min,取上清,按检测试剂盒说明书测定小鼠胰组织SOD、CAT和GPx活性。
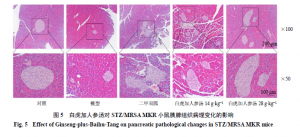
2.10 白虎加人参汤对STZ/MRSAMKR小鼠胰腺组织病理变化的影响
将新鲜胰腺组织置于4%多聚甲醛中固定,脱水、透明后,用石蜡包埋,切片和烘干后,用二甲苯与梯度乙醇脱蜡,行HE染色,于显微镜下观察并拍照,并且使用Image J 8.0软件进行分析,测量各组胰岛面积,计算各组小鼠单个胰岛的平均面积。
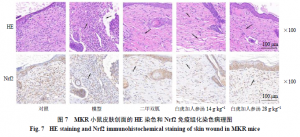
2.11 白虎加人参汤对STZ/MRSAMKR小鼠皮肤组织病理变化的影响
剪取小鼠背部皮肤组织,置于4%多聚甲醛中固定24 h以上,脱水、透明后,用石蜡包埋。切片、烘干、脱蜡至水后,一部分皮肤组织切片进行HE染色,一部分皮肤组织切片经过抗原修复、3% H2O2溶液孵育10 min淬灭内源性过氧化物酶活性、5%血清封闭10 min、一抗4 ℃孵育过夜、二抗室温孵育30 min、显色、染核等步骤,进行Nrf2免疫组化染色,最后在显微镜下观察并拍照。
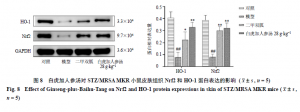
2.12 白虎加人参汤对STZ/MRSAMKR小鼠皮肤组织Nrf2和HO-1蛋白表达的影响
剪取适量小鼠背部皮肤组织,用SDS裂解液在生物样品均质仪中研磨裂解皮肤组织,提取总蛋白。蛋白上清与loadingbuffer混匀并煮沸,制备变性蛋白待用。电泳2.5 h,转膜后用5%脱脂奶粉封闭,4 ℃过夜;分别加入Nrf2(1∶1000)、HO-1(1∶2000)、GAPDH(1∶3000)抗体孵育90 min,用PBST洗涤3次,加入HRP标记的山羊抗兔IgG抗体(1∶6000)孵育90 min,最后用ECL化学发光液显色,在化学发光成像系统仪内拍照。
2.13 统计学分析
实验结果以表示,采用GraphPad Prism 5.0软件进行数据处理和统计分析,采用单因素方差分析进行组间比较。
3 结果
3.1 白虎加人参汤对STZ/MRSA MKR小鼠体质量的影响
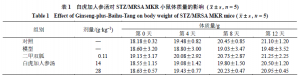
如表1所示,从感染MRSA到创面逐渐愈合,各组小鼠的体质量保持平稳无明显波动,不具有统计学差异。
3.2 白虎加人参汤对STZ/MRSA MKR小鼠伤口变化的影响
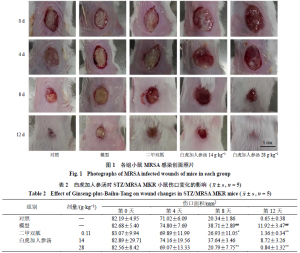
如图1和表2所示,与对照组比较,模型组小鼠创面愈合缓慢,在给药第8天创面面积显著大于对照组(P<0.01),并可见创面上覆大量黄色浑浊脓液;在给药第12天创面仍有脓液分泌,创面面积显著大于对照组(P<0.01)。与模型组比较,给药第8天,二甲双胍组小鼠背部创面一定程度愈合,创面相对干燥上覆蜜黄色厚痂,创面面积减小(P<0.05);白虎加人参汤低剂量组小鼠创面面积变化较模型组不具有统计学差异,从图中可见创面呈糜烂状态,有淡黄色清稀渗出液;白虎加人参汤高剂量组小鼠背部创面显著自愈(P<0.01),创面仅见少量清澈的血性分泌物,创面周边毛发恢复生长。给药第12天,与模型组比较,二甲双胍组创面显著愈合(P<0.01),创面干燥结痂,周边毛发恢复生长;白虎加人参汤低剂量组小鼠创面干燥、糜烂减轻,但愈合程度较模型组无统计学差异;白虎加人参汤高剂量组小鼠创面显著自愈(P<0.01),痂吸收脱落,背部毛发生长基本全面恢复。
3.3 白虎加人参汤对STZ/MRSA MKR小鼠糖代谢的影响
如表3所示,与对照组比较,模型组小鼠在实验过程中全程处于高血糖状态(P<0.01);与模型组比较,给药第8天,白虎加人参汤高剂量组小鼠FBG下降(P<0.05),给药第12天,二甲双胍组和白虎加人参汤高剂量组小鼠FBG均显著下降(P<0.01);白虎加人参汤低剂量组小鼠FBG与模型组无统计学差异。
如表4所示,与对照组比较,模型组小鼠血清胰岛素、血清C肽水平显著下降(P<0.01),糖化血清蛋白含量显著上升(P<0.01);与模型组比较,各给药组小鼠血清胰岛素水平均显著上升(P<0.01),GSP水平均显著下降(P<0.05、0.01),C肽水平无统计学差异。
3.4 白虎加人参汤对STZ/MRSA MKR小鼠全身性炎症水平的影响
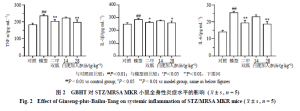
如图2所示,与对照组比较,模型组小鼠血清中TNF-α、IL-1β和IL-6水平均显著升高(P<0.01);与模型组比较,二甲双胍组和白虎加人参汤高剂量组小鼠血清中TNF-α、IL-6和IL-1β水平均显著下降(P<0.05、0.01),白虎加人参汤低剂量组无统计学差异。
3.5 白虎加人参汤对STZ/MRSAMKR小鼠全身性氧化应激水平的影响
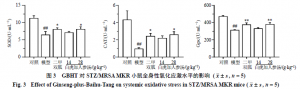
如图3所示,与对照组比较,模型组小鼠血清中SOD、CAT和GPx活性均显著下降(P<0.01);与模型组比较,二甲双胍组和白虎加人参汤高剂量组小鼠血清SOD、CAT和GPx活性显著上升(P<0.05、0.01),白虎加人参汤低剂量组无统计学差异。
3.6 白虎加人参汤对STZ/MRSAMKR小鼠胰腺氧化应激水平的影响
如图4所示,与对照组比较,模型组小鼠胰腺组织SOD、CAT和GPx活性均显著下降(P<0.01);与模型组比较,二甲双胍组小鼠胰腺组织SOD和CAT活性显著上升(P<0.01),白虎加人参汤低剂量组小鼠胰腺组织CAT活性显著上升(P<0.05),白虎加人参汤高剂量组小鼠胰腺组织SOD、CAT和GPx活性均显著上升(P<0.05、0.01)。
3.7 白虎加人参汤对STZ/MRSAMKR小鼠胰腺组织病理变化的影响
如图5、6所示,对照组小鼠的胰岛边界清晰,形态呈较规则的圆形,质地致密,胰岛内胰岛细胞数量丰富、排列规整、胞质丰富,胰岛内毛细血管盘绕曲折,未见血管扩张。与对照组相比,模型组小鼠的胰岛数目及胰岛面积显著缩小(P<0.01),胰岛内胰岛细胞数量减少、排列紊乱、形态不一,可见到细胞核固缩、大小不一,并可见到明显的血管充血扩张。与模型组比较,各给药组小鼠胰腺组织的病理改变有不同程度的改善,二甲双胍组小鼠胰岛面积显著增加(P<0.01),胰岛边界清晰,胰岛细胞数量增多、大小基本一致、细胞排列较为规则,细胞核大小基本一致,胰岛内血管充血扩张明显减轻;白虎加人参汤低剂量组小鼠胰岛数量较模型组增加,但平均的单个胰岛面积变化与模型组之间无统计学差异,胰岛质地疏松,边界不甚清晰,虽然胰岛细胞数量一定程度增加,但可见细胞核排列紊乱、染色不均匀,部分细胞呈空泡变性,并且胰岛中血管充血扩张明显;白虎加人参汤高剂量组小鼠胰岛面积显著增加(P<0.01),胰岛呈椭圆形或圆形,边界清晰,质地致密,胰岛中胰岛细胞数量明显增加,细胞分布均匀,胰岛内血管充血明显减轻。
3.8 白虎加人参汤对STZ/MRSA MKR小鼠皮肤组织病理变化的影响
如图7所示,对照组小鼠皮肤组织的HE染色图中表皮层及真皮层结构清晰,表皮层较薄,棘层约为2~3层细胞,基底层细胞排列整齐呈矮柱状,真皮层可见清晰的皮脂腺、新生的毛细血管,排列整齐的胶原纤维;Nrf2免疫组化染色图中阳性信号明显、相关抗原表达丰富。与对照组小鼠相比,模型组小鼠HE染色图中无完整的表皮层,真皮层结构被严重损坏,胶原纤维生成减少、排列紊乱,并见其中有大量炎症细胞浸润;Nrf2免疫组化染色图中抗原表达低。与模型组小鼠比较,各给药组小鼠皮肤创面有不同程度的恢复,HE染色图中可见小鼠表皮层不同程度地恢复,真皮层中见不同程度的胶原纤维增生,白虎加人参汤低剂量组小鼠皮肤组织中胶原纤维明显凝聚呈条索状,其中可见少量浸润的炎症细胞,二甲双胍组和白虎加人参汤高剂量组小鼠皮肤组织真皮层较白虎加人参汤低剂量组真皮层质地更为致密,胶原纤维增生明显,排列更为有序;在Nrf2免疫组化图中可见白虎加人参汤高剂量组小鼠皮肤中的抗原表达最为丰富,阳性信号最为强烈,二甲双胍组小鼠皮肤中抗原表达略低,白虎加人参汤低剂量组小鼠皮肤中抗原表达为用药组中最低。
3.9 白虎加人参汤对STZ/MRSAMKR小鼠皮肤组织Nrf2和HO-1蛋白表达的影响
如图8所示,与对照组比较,模型组小鼠皮肤组织中HO-1和Nrf2蛋白表达水平均显著下降(P<0.01);与模型组比较,二甲双胍组和白虎加人参汤高剂量组小鼠皮肤组织中HO-1和Nrf2蛋白表达水平均显著升高(P<0.05、0.01)。
4 讨论
随着糖尿病患者的护理标准日渐全面,许多糖尿病相关并发症,特别是大血管疾病所引发的死亡率急剧下降。然而据统计,糖尿病并发伤口感染、脓毒症、蜂窝组织炎等感染性疾病的患者数量是非糖尿病患者的4倍,并且患者数量仍在惊人地增加[14]。临床研究显示,糖尿病患者较差的伤口愈合能力成为诱发感染性疾病的重要原因[15]。一方面,由于糖尿病患者血糖升高,皮肤组织的含糖量增高,给细菌感染创造了良好环境;另一方面,与正常组织中典型的凝血、炎症、增殖、重塑等生理过程依次顺序出现不同,糖尿病患者伤口愈合的正常进程被氧化应激扰乱和延迟,创面局部显著升高的ROS导致伤口难以愈合[6-7]。高水平ROS阻碍正常的ECM的生成,并损害已经存在的ECM,如H2O2会破坏组织生长,特别是胶原蛋白的生成,从而阻止伤口愈合[16-17]。同时,ROS介导炎症反应的发生,导致TNF-α、IL-1β、IL-6等相关炎症因子表达升高。糖尿病患者全身性的、低度的与创面局部的、加重的炎症反应,同样导致创面难以愈合。因此,降低血糖与抗氧化应激成为治疗糖尿病并发创面感染的关键。
高血糖与氧化应激有复杂的相互关系,二者互为因果又相互加剧[18-20]。慢性高血糖通过多种分子途径诱导自由基的产生[21-22]。高水平的ROS导致功能性胰岛β细胞数量下降、胰岛体积减小,并且通过促进脂质过氧化、DNA断裂、蛋白质聚集、蛋白质变性和蛋白质碎裂等[23-26],导致大分子不可逆转的损害,这些都可能导致胰岛β细胞功能障碍甚至凋亡[27-28],从而导致葡萄糖刺激的胰岛素分泌减少[29-30],血糖升高,进一步加剧氧化应激。
Nrf2作为细胞氧化还原状态的中央调节因子,调控HO-1、GPx、SOD和CAT等250多种不同的抗氧化酶[31]。目前,Nrf2通路被认为在肥胖、糖尿病、动脉粥样硬化、高血压、帕金森、阿茨海默症等多种疾病中起到防御作用,Nrf2主要通过清除ROS减少氧化损伤来发挥保护作用[32]。越来越多的证据表明,糖尿病中Nrf2通路的激活对保护和保存功能性β细胞群至关重要[33]。除了增加存活率外,Nrf2表达上调还可促进β细胞增殖,从而增加功能性β细胞数量[34]。Nrf2还可通过多种途径促进葡萄糖刺激的胰岛素分泌[35],并且,胰岛素也促进Nrf2转位入核以及激活其下游抗氧化蛋白的表达[36]。Nrf2靶基因的表达,在糖尿病患者的皮肤组织和糖尿病模型大鼠的成纤维细胞中,急剧下降[37-38]。综上所述,保护胰岛β细胞的功能与数量、激活Nrf2的信号表达,可改善血糖、抑制氧化应激与炎症反应,从而加速伤口闭合[39],这个结论也在针对Nrf2−/−糖尿病小鼠创口的实验中得到验证[40]。
目前已知的绝大多数Nrf2激活剂是天然产物,有中药单体成分如芦丁、芒果苷、黄芩苷、人参皂苷Rg1等,也有中药复方如复方黄柏液[38,41]。这些药物的起效机制主要围绕着激活Nrf2信号通路、减轻氧化损伤,以达到促进伤口愈合的目的。由于糖尿病合并创面感染既有局部的显著病变又有同时伴发的全身性基础疾病,因此区别于传统的外治法,推测是否可以通过内治法作用于全身性基础性疾病——糖尿病,进而改善局部病变——创面感染,提高机体自愈能力,实现标本兼顾。中医学认为,创面感染属于“疮疡”范畴,糖尿病合并创面感染即是“消渴病合并疮疡”,主要病机是消渴气阴两虚、燥热内结、毒蕴瘀阻而发病[42]。汉代张仲景创立的用治肺胃热盛、气阴两虚消渴病的白虎加人参汤,其主要组成药物石膏知母清热滋阴,泄内蕴热毒;人参扶助正气,补气以祛瘀;甘草粳米共奏健脾固表之功,助机体托毒外出。白虎加人参汤在临床中被应用于单纯性的皮肤瘙痒、脓毒症、荨麻疹、特应性皮炎等皮肤疾病而见奇效[43]。同时,立足于本课题组对白虎加人参汤具有调节血糖、抗氧化应激、保护胰岛β细胞等作用的前期研究基础[8-10],尝试以内治法应用白虎加人参汤于2型糖尿病合并创面感染的动物模型,探索其治疗效果及作用机制。
本实验采用已成熟用于研究2型糖尿病的模型动物MKR转基因小鼠[44-45],5周龄左右便已显现出胰岛素抵抗、糖耐量异常、炎性因子表达升高等特征,辅以STZ干预诱导形成稳定的2型糖尿病模型后,在小鼠背部制备创面并滴加菌液进行感染。临床观察与实验研究发现,虽然糖尿病患者易感细菌以金黄色葡萄球菌为主[46],但由于糖尿病所致免疫缺陷及临床中抗生素的过度使用[47-48],MRSA的感染率逐年上升[49],因此采用MRSA作为小鼠创面感染菌株。本实验以二甲双胍作为阳性对照药物,观察比较白虎加人参汤低、高剂量的治疗效果。实验结果显示,与对照组相比,模型组小鼠创面愈合迟缓、糖代谢异常、血清炎性因子表达升高、抗氧化能力显著下降,组织病理学显示胰腺中胰岛β细胞受损明显、胰岛面积显著下降,皮肤组织结构破坏严重、炎性浸润明显、Nrf2信号低表达。与模型组比较,白虎加人参汤组有不同程度的改善,尤其是白虎加人参汤高剂量组,在促进创面愈合、降低血糖、促进胰岛素分泌、抗炎抗氧化等方面表现更为突出,组织病理学观察同样支持这一结论,高剂量白虎加人参汤显著保护胰岛β细胞、促进皮肤胶原纤维合成、增强皮肤组织中Nrf2信号表达;进一步检测Nrf2、HO-1的蛋白表达,高剂量白虎加人参汤显著激活皮肤组织的Nrf2/HO-1信号通路。
知母与人参是白虎加人参汤中主要组成药物,并且Nrf2的激活剂芒果苷、人参皂苷Rg1,分别是知母与人参中重要的有效成分,这可能是白虎加人参汤能够调节Nrf2/HO-1信号通路表达的原因。现代药理学研究中,芒果苷已被证明具有较好的抗氧化、抗炎、改善糖脂代谢的作用[50],人参皂苷Rg1被证明具有提高肝糖原合成、提高胰岛素敏感性的作用[51]。同时,由于芒果苷的溶解度极低,在水中的溶解度仅为0.111 mg/mL[52],在肠道中的生物利用度也仅为1.2%[53],而高剂量的白虎加人参汤中芒果苷与人参皂苷含量更高,这可能是白虎加人参汤高剂量组治疗效果更为显著的重要原因。
综上所述,本研究发现白虎加人参汤通过降低STZ/MRSA MKR小鼠FBG、提高机体抗氧化能力、保护胰岛β细胞、激活皮肤组织中的Nrf2/HO-1信号通路,有效治疗糖尿病、促进创面愈合,这为白虎加人参汤的新应用提供了实验依据,也为进一步研究白虎加人参汤通过Nrf2/HO-1信号通路治疗糖尿病、探索芒果苷等中药单体成分在糖尿病合并创面感染中的应用奠定基础。
利益冲突 所有作者均声明不存在利益冲突
参考文献(略)
来 源:刘 旭,钟国威,刘天晟,喻 嵘,谭丹妮,向 琴,刘 秀.白虎加人参汤对MKR转基因2型糖尿病小鼠创面感染的作用 [J]. 中草药, 2022, 53(10): 3032-3043 .